
【題目】25℃時,體積均為V0且pH相同的MOH與ROH溶液,分別加水稀釋至V,pH隨![]() 變化如圖所示。下列說法正確的是( )
變化如圖所示。下列說法正確的是( )
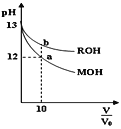
A.MOH為一元強堿
B.a點溶液的導電性大于b點溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的電離程度:a點小于b點
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】在恒溫恒容的密閉容器中通入lmolX和2molY,發生下列反應:X(g)+2Y(g)![]() M(g)+2N(g) △H=akJ/mol(a>0),下列說法中正確的是
M(g)+2N(g) △H=akJ/mol(a>0),下列說法中正確的是
A. 到達平衡狀態時,加入催化劑,平衡不移動,反應速率也不會發生改變
B. 反應達到平衡時,X和Y的轉化率相等
C. v正(X)=2v逆(N)時,反應到達平衡狀態
D. 到達平衡狀態時,反應吸收akJ能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種以輝銅礦(主要成分為Cu2S,含少量SiO2)為原料制備硝酸銅的工藝流程如圖所示:

(1)寫出“浸取”過程中Cu2S溶解時發生反應的離子方程式:___。
(2)恒溫“浸取”的過程中發現銅元素的浸取速率先增大后減少,有研究指出CuCl2是該反應的催化劑,該過程的反應原理可用化學方程式表示為:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”過程中溫度控制在50~60℃之間,不宜過高的原因是___。
(4)向濾液M中加入(或通入)___(填字母),可得到一種可循環利用的物質。
a.鐵 b.氯氣 c.高錳酸鉀 d.氯化氫
(5)“保溫除鐵”過程中,加入CuO的目的是__;“蒸發濃縮、冷卻結晶”過程中,要用HNO3溶液調節溶液的pH,其理由_。
(6)輝銅礦可由黃銅礦(主要成分為CuFeS2)通過電化學反應轉變而成,有關轉化見圖,轉化時轉移0.2mol電子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組同學對由NaHCO3和KHCO3組成的某均勻混合物進行實驗,測得如下數據(鹽酸的物質的量濃度相等):
50mL鹽酸 | 50mL鹽酸 | 50mL鹽酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
標準狀況下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)鹽酸的物質的量濃度為_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化物等大氣污染物對打造宜居環境具有重要意義。NO在空氣中存在如下反應:2NO(g)+O2(g)![]() 2NO2(g),其反應歷程分兩步:
2NO2(g),其反應歷程分兩步:
①2NO(g)![]() N2O2(g)(快反應) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
N2O2(g)(快反應) v1正=k1正·c2(NO), v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢反應) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
2NO2(g)(慢反應) v2正=k2正·c(N2O2)·c(O2), v2逆=k2逆·c2(NO2) ΔH2<0
反應歷程的能量變化如圖:
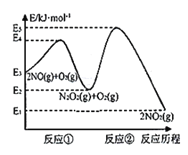
請回答下列問題:
(1)反應2NO(g)+O2(g)![]() 2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
2NO2(g)的ΔH__0(填“>”、“<”或“=”)。
(2)決定2NO(g)+O2(g)![]() 2NO2(g)反應速率是反應②,E4+E2__E5+E3(填“>”、“<”或“=”)。
2NO2(g)反應速率是反應②,E4+E2__E5+E3(填“>”、“<”或“=”)。
(3)一定溫度下,反應2NO(g)+O2(g)![]() 2NO2(g)達到平衡狀態,寫出用k1正、k1逆、k2正、k2逆表示平衡常數的表達式K=___。
2NO2(g)達到平衡狀態,寫出用k1正、k1逆、k2正、k2逆表示平衡常數的表達式K=___。
(4)T1℃下一密閉容器中充入一定量的NO2,測得NO2濃度隨時間變化的曲線如圖所示。前5秒內O2的平均生成速率為___;T1℃下反應2NO(g)+O2(g)![]() 2NO2(g)的化學平衡常數K=__。
2NO2(g)的化學平衡常數K=__。
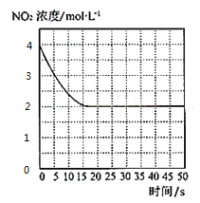
(5)對于(4)中的反應體系達平衡后,若降低溫度,再次達平衡后,混合氣體的平均相對分子質量___(填“增大”、“減小”或“不變”);對于(4)中的反應體系達平衡后,若在恒溫恒容條件下,追加NO2,再次達平衡后,NO2的體積分數___(填“增大”、“減小”或“不變”)。
(6)對于(4)中的反應體系達平衡后(壓強為P1),若在恒溫恒容條件下,向其中充入一定量O2,再次達平衡后,測得壓強為P2,P1︰P2 = 5︰8,則再次平衡時NO2的濃度為___mol·L-1。(精確到小數點后兩位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M 均為中學化學中常見物質,一定條件下它們之間有如下轉化關系(其它產物已略去)。下列說法中不正確的是( )
![]()
A.若 M 是單質鐵,則 Z 溶液可能是 FeCl2 溶液
B.若 M 是氫氧化鈉,則 X 水溶液呈酸性
C.若 M 是氧氣,則 X、Z 的相對分子質量可能相差 48
D.若 M 是強氧化性的單質,則 X 可能是金屬鋁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,已達平衡的可逆反應:2A(g)+B(g)![]() 2C(g),下列說法中正確的是 ( )
2C(g),下列說法中正確的是 ( )
A. 平衡時,此反應的平衡常數K與各物質的濃度有如下關系:K=![]()
B. 改變條件后,該反應的平衡常數K一定不變
C. 如果改變壓強并加入催化劑,平衡常數會隨之變化
D. 若平衡時增加A和B的濃度,則平衡常數會減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莫爾鹽[硫酸亞鐵銨,(NH4)2Fe(SO4)26H2O,Mr=392]是一種重要的還原劑,在空氣中比一般的亞鐵鹽穩定,易溶于水,難溶于乙醇。某學習小組設計如下實驗制備少量的莫爾鹽并測定其純度。

回答下列問題:
Ⅰ.制取莫爾鹽
i.連接裝置,檢査裝置氣密性。將13.2g(NH4)2SO4晶體置于三頸燒瓶B中,將6.0g潔凈鐵屑加入錐形瓶中。
ii.打開儀器a瓶塞,關閉活塞K3,打開K2、K1,加完55.0mL2mol·L-1稀硫酸后關閉K1。
iii.待大部分鐵粉溶解后,打開K3、關閉K2,A中淺綠色溶液流入B。
iv.關閉活塞K2、K3,采用100℃水浴蒸發三頸燒瓶中水分,液面產生晶膜時,停止加熱,冷卻結晶、過濾、洗滌晶體。
(1)儀器a的名稱是___。
(2)操作iii中淺綠色溶液會流入B的原因是___。
(3)操作iv中洗滌晶體所用試劑是___(填標號)。
A.水 B.無水乙醇 C.硫酸溶液
Ⅱ.為測定所得莫爾鹽晶體純度,取mg該樣品配制成1L溶液,分別設計如下兩個實驗方案,請回答:
方案一:取20.00mL所配硫酸亞鐵銨溶液用0.1000mol·L-1的酸性K2Cr2O7溶液進行滴定。重復三次。(已知:Cr2O72-還原產物為Cr3+)
(4)寫出此反應的離子方程式___。
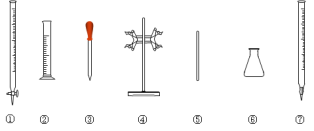
(5)滴定時必須選用的儀器是___。(填標號)
方案二:取20.00mL所配硫酸亞鐵銨溶液進行如下實驗。
![]()
(6)莫爾鹽晶體純度為___。(用含m、w的式子表示)
(7)若實驗操作都正確,但方案一的測定結果總是小于方案二,其可能原因為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)1807年,英國化學家戴維在研究中發現:電解條件下可把水分解成H2和O2。他設想用電解的方法從KOH、NaOH中分離出K和Na。最初,戴維用飽和KOH溶液進行電解,不料還是得到H2和O2。這時,他考慮在無水條件下繼續這項實驗,但是,實驗中產生的金屬液珠一接觸空氣就立即燃燒起來;這時,他又考慮在________條件下電解熔融的KOH繼續實驗,最后他終于成功地得到了銀白色的金屬鉀。
(2)最近,德國科學家實現了銣原子氣體超流體態與絕緣態的可逆轉換,該成果將在量子計算機研究方面帶來重大突破。已知銣是37號元素,質量數是85。根據材料回答下列問題:
Ⅰ.銣位于元素周期表的第________周期________族。
Ⅱ.關于銣的下列說法中正確的是________(填序號,下同)。
①與水反應比鈉更劇烈 ②Rb2O在空氣中易吸收水和二氧化碳 ③Rb2O2與水能劇烈反應并釋放出O2④它是極強的還原劑 ⑤RbOH的堿性比同濃度的NaOH弱
Ⅲ.現有銣和另一種堿金屬形成的合金5g,與足量水反應時生成標準狀況下的氣體2.24 L,則另一堿金屬可能是________(填元素符號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com