

分析 ①II中首先鍍銅,則Cu作陽極、Fe作陰極,I中a處電極為負極、b處電極為正極,負極上通入燃料、正極上通入氧化劑;C2H4失電子和氫氧根離子反應生成碳酸根離子和水;
②根據I中氫氧根離子濃度變化確定溶液pH變化;II中發生電鍍,陽極上溶解的銅質量等于陰極上析出銅的質量;
③I中還有碳酸根離子生成;
④根據轉移電子相等計算消耗甲烷的體積.
解答 解:①II中首先鍍銅,則Cu作陽極、Fe作陰極,I中a處電極為負極、b處電極為正極,負極上通入燃料、正極上通入氧化劑,所以a處通入的氣體是C2H4;C2H4失電子和氫氧根離子反應生成碳酸根離子和水,電極反應為C2H4+16OH--12e-═2CO32-+10H2O,
故答案為:C2H4;C2H4+16OH--12e-═2CO32-+10H2O;
②根據I中電池反應為C2H4+3O2+4KOH=2K2CO3+4H2O,KOH參加反應導致溶液中KOH濃度降低,則溶液的pH減小;
II中發生電鍍,陽極上溶解的銅質量等于陰極上析出銅的質量,則溶液中銅離子濃度不變,
故答案為:變小;不變;
③I中負極反應為C2H4+16OH--12e-═2CO32-+10H2O,所以還有碳酸根離子生成,故答案為:CO32-;
④裝置Ⅱ中陰極質量變化12.8g,則轉移電子為$\frac{12.8g}{64g/mol}$×2=0.4mol,串聯電路中轉移電子相等,所以消耗乙烯的體積=$\frac{1}{12}$×0.4mol×22.4L/mol≈0.75L,
故答案為:0.75.
點評 本題考查了原電池和電解池原理,根據電解池中Cu、Fe電極上發生的反應確定燃料電池中正負極及電極上通入的氣體,再結合轉移電子相等計算,難點是電極反應式的書寫,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 玻璃是人類是早使用的硅酸鹽材料 | |
| B. | 玻璃在加熱熔化時有固定的熔點 | |
| C. | 制普通玻璃的主要原料是純堿、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸鈉、硅酸鈣和二氧化硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
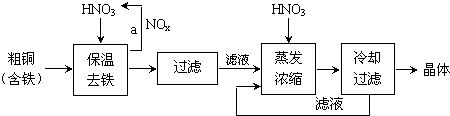
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
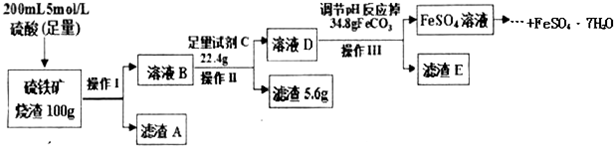
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
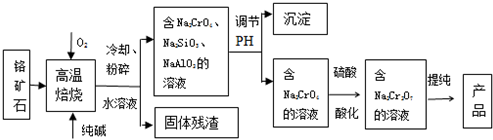
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com