
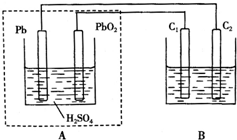
 用鉛蓄電池作電源電解某溶液100mL.已知該溶液中含SO2、KI,其物質的量濃度均為0.1mol/L,如圖所示(C1、C2為石墨電極),下列說法正確的是( )
用鉛蓄電池作電源電解某溶液100mL.已知該溶液中含SO2、KI,其物質的量濃度均為0.1mol/L,如圖所示(C1、C2為石墨電極),下列說法正確的是( )| A. | 鉛蓄電池工作一段時間后A溶液的pH變小 | |
| B. | 當B燒杯中I-的濃度降為0.05mol/L時,消耗A中的H2SO4的物質的量為0.025mol | |
| C. | 當C1、C2兩極均產生氣體時,應有至少3.6×1022個電子從電路中流過 | |
| D. | 鉛蓄電池工作時負極電極反應式為:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
分析 A、根據鉛蓄電池放電時,溶液中氫離子濃度的變化判斷溶液PH的變化;
B、當B燒杯中I-的濃度降為0.05mol/L時消耗的物質的量=0.05×0.1=0.005mol,轉移電子0.005mol;
C、當電解池中陽極上生成氣體時,碘離子應該完全放電生成導致碘,然后氫氧根離子放電生成氧氣;
D、鉛蓄電池放電時,負極上失去電子發生氧化反應.
解答 解:A、鉛蓄電池工作時反應:PbO2+2H2SO4+Pb═2PbSO4+2H2O,氫離子濃度減小,所以溶液的PH增大,故A錯誤;
B、當B燒杯中I-的濃度降為0.05mol/L時消耗的物質的量=0.05×0.1=0.005mol,轉移電子0.005mol,2H2O+SO2-2e-=SO42-+4H+,轉移電子=0.1×0.1×2=0.02mol,共轉移0.025mol,據PbO2+2H2SO4+Pb═2PbSO4+2H2O得知轉移2mol的電子消耗2mol的硫酸,所以消耗硫酸0.025mol,故B正確;
C、當C1、C2兩極均開始產生氣體時,碘離子放電完全,根據碘離子的物質的量計算通過的電子個數,碘離子的物質的量=0.1mol/L×0.1L=0.01mol,
2I--2e-=I2
2mol 2NA
0.01mol 0.01NA
所以至少已有6.02×1021個電子從電路中流過,故C錯誤;
D、鉛蓄電池放電時,負極上鉛失去電子和硫酸根離子反應生成硫酸鉛,電極反應式為 Pb+SO42--2e-=PbSO4,故D錯誤;
故選B.
點評 本題考查了原電池原理和電解池原理,明確溶液中氫離子濃度的變化、離子的放電順序、原電池中正負極的反應即可分析解答本題,難度不大.


 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:選擇題
| A. | 赤潮、白色污染、綠色食品都與相關物質的顏色有關 | |
| B. | 地震發生后,災區急需大量消毒劑,其中SO2可用于環境消毒 | |
| C. | 利用太陽能等清潔能源代替化石燃料,有利于節約能源,保護環境 | |
| D. | 電池一定要回收利用,主要是為了避免浪費 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 貯存液氮的鋼瓶防止陽光直射:N2+O2$\frac{\underline{\;陽光\;}}{\;}$2NO | |
| B. | 硝酸銨遇熱爆炸:2NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+O2↑+4H2O↑ | |
| C. | 干燥的 AlCl3遇水產生氣體:AlCl3+3H2O═Al(OH)3+3HCl↑ | |
| D. | 火災現場存有電石,禁用水滅火:CaC2→Ca(OH)2+C2H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根個數為0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-離子總數為NA | |
| C. | 2.4g金屬鎂與足量的鹽酸反應,轉移電子數為2 NA | |
| D. | 標準情況下,22.4LCl2和HCl的混合氣體中含分子總數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
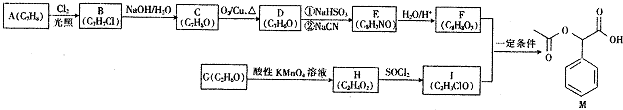
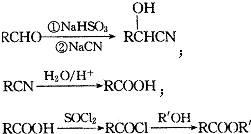 ;
;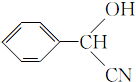 ;
; ;
;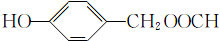 (填結構簡式).
(填結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該固體中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 該固體中一定沒有Cu2+、Cl-、Na+ | |
| C. | 該固體中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根據以上實驗,無法確定該固體中有Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y元素含氧酸的酸性比W的弱 | |
| B. | Z和W在自然界均能以游離態存在 | |
| C. | YZ和YZ2均可以被NaOH溶液吸收 | |
| D. | X和Y能形成既含極性鍵又含非極性鍵的分子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com