
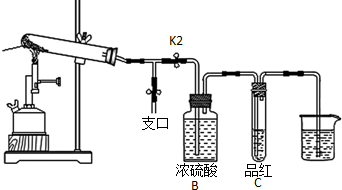
分析 (1)A、生成N2,N元素化合價升高,生成SO2,S元素化合價降低,符合氧化還原反應原理,預測合理;B、生成NH3、SO3、H2O,為非氧化還原反應,預測合理;C、生成SO2,S元素化合價降低,無元素化合價升高,不符合氧化還原反應原理,預測不合理;D、既有元素化合價升高,也有元素化合價降低,預測合理.
(2)①利用加熱氣體膨脹的原理檢驗裝置的氣密性,設計實驗過程;
②用濃鹽酸檢驗NH3,打開K1,用蘸有濃鹽酸的玻璃棒靠近支口,若出現白煙,證明含有NH3,但不能用潤濕的石蕊試紙,因為混合氣體中含有SO2,SO3,試紙不可能變藍;裝置A與B之間的T型導管中出現白色固體可能是SO2與NH3反應生成的(NH4)2SO3,或SO3與NH3反應生成的(NH4)2SO4,或SO3固體,或酸式鹽及以上物質的混合物.
③A試管中殘留的白色固體是兩性氧化物,則A為Al2O3,與NaOH溶液反應生成偏鋁酸鈉和水;
(3)根據氧化還原反應中化合價升高的總價數與降低的總價數相等,結合相同條件下氣體物質的量之比等于體積之比得到
解答 解:(1)A、生成N2,N元素化合價升高,生成SO2,S元素化合價降低,符合氧化還原反應原理,預測合理,故A正確;
B、生成NH3、SO3、H2O,為非氧化還原反應,預測合理,故B正確;
C、生成SO2,S元素化合價降低,無元素化合價升高,不符合氧化還原反應原理,預測不合理,故C錯誤;
D、既有元素化合價升高,也有元素化合價降低,預測合理,故D正確;
故答案為:C;
(2)①利用加熱氣體膨脹的原理檢驗裝置的氣密性,首先要關閉支口開關K1并打開K2,然后將最后的導管通入水中,微熱大試管,若看到從導管中出現氣泡,且停止加熱后在導管中上升一段水柱,則證明氣密性好;
故答案為:關閉支口開關K1并打開K2,將最后的導管通入水中,微熱大試管,若看到從導管中出現氣泡,且停止加熱后在導管中上升一段水柱,則證明氣密性好好;
②用濃鹽酸檢驗NH3,打開K1,用蘸有濃鹽酸的玻璃棒靠近支口,若出現白煙,證明含有NH3,但不能用潤濕的石蕊試紙,因為混合氣體中含有SO2,SO3,試紙不可能變藍;裝置A與B之間的T型導管中出現白色固體可能是SO2與NH3反應生成的(NH4)2SO3,或SO3與NH3反應生成的(NH4)2SO4,或SO3固體,或酸式鹽及以上物質的混合物;
故答案為:打開K1,用蘸有濃鹽酸的玻璃棒靠近支口,若出現白煙或用潤濕的紅色石蕊試紙變藍檢驗;(NH4)2SO4或者(NH4)2SO3或者SO3或酸式鹽及以上物質的混合物;
③A試管中殘留的白色固體是兩性氧化物,則A為Al2O3,與NaOH溶液反應生成偏鋁酸鈉和水,其反應的離子方程式為:Al2O3+2OH-=2AlO2-+H2O,
故答案為:Al2O3+2OH-=2AlO2-+H2O;
(3)根據氧化還原反應中化合價升高的總價數與降低的總價數相等,可得:6n(N2)=2n(SO2),可得 n(N2):n(SO2)=1:3,相同條件下氣體物質的量之比等于體積之比,所以V(N2):V(SO2)=1:3,
故答案為:1:3.
點評 本題考查探究物質組成的實驗方案設計與分析、氧化還原反應原理及計算、基本操作、離子方程式的書寫等,側重于考查學生的實驗探究能力和對基礎知識的綜合應用能力,注意物質性質的理解應用,掌握基礎是解題關鍵,題目難度中等.


 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 要清洗附著在試管壁上的硫,可用的試劑是CS2 | |
| B. | 硫化亞鐵溶于稀硝酸中反應的化學方程式為:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常溫下濃硫酸能使鋁發生鈍化,可在常溫下用鋁制容器貯運濃硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入過量的稀硫酸,能產生氣泡并有沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2使溴水褪色,顯示了SO2的漂白性 | |
| B. | SO2使溴水褪色,顯示了SO2的還原性 | |
| C. | 從溴水中提取單質溴,可以用乙醇進行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N5+共有34個核外電子 | B. | N5+中氮原子間以共價鍵結合 | ||
| C. | 化合物N5ASF6中AS的化合價為+1價 | D. | 化合物N5ASF6中F的化合價為-1價 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 碳氧化物、氮氧化物、二氧化硫的處理與利用是世界各國研究的熱點問題.消除汽車尾氣中的NO、CO,有利于減少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的處理與利用是世界各國研究的熱點問題.消除汽車尾氣中的NO、CO,有利于減少PM2.5的排放.已知如下信息:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該有機物含碳.氫.氧三種元素 | |
| B. | 該化合物是乙烷 | |
| C. | 該化合物分子中碳.氫原子個數之比是2:3 | |
| D. | 該有機物含2個碳原子,6個氫原子,但不能確定是否含氧原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. .
.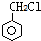 的屬于芳香族化合物的同分異構體有3種.
的屬于芳香族化合物的同分異構體有3種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 先加入BaCl2溶液產生白色沉淀,再加入足量稀鹽酸沉淀不溶解 | |
| B. | 先加入足量稀鹽酸無沉淀,再加入BaCl2溶液產生白色沉淀 | |
| C. | 先加入足量稀硝酸無沉淀,再加入Ba(NO3)2溶液產生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液無沉淀,再加入足量稀硝酸產生白色沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com