
| A. | 加入20g 固體NaOH,攪拌、溶解 | |
| B. | 將溶液加熱濃縮至0.6 L | |
| C. | 加入10mol/L的NaOH溶液0.1 L,再稀釋至1.5 L | |
| D. | 加入1 L 1.5 mol/L的NaOH溶液混合均勻 |
分析 1L 0.5mol/L的NaOH溶液的濃度增大一倍,即改變后的溶液的濃度是1mol/L,
A.20g氫氧化鈉的物質的量為0.5mol,向1L溶液中進入0.5mol氫氧化鈉固體,溶液的體積會發生變化,所以溶液濃度不等于1mol/L;
B.將溶液加熱濃縮至0.6L,溶液的濃度變為原先的:$\frac{1L}{0.6L}$=$\frac{5}{3}$倍;
C.先計算出氫氧化鈉的總物質的量,然后根據c=$\frac{n}{V}$計算出所得溶液的濃度;
D.兩溶液混合后溶液的體積會發生變化,混合液體積不等于2L.
解答 解:1L 0.5mol/L的NaOH溶液的濃度增大一倍,即改變后的溶液的濃度是1mol/L,
A.加入20g固體NaOH,攪拌、溶解,由于溶解后的溶液體積會發生變化,氫氧化鈉的物質的量為1mol,但是溶液的體積不是1L,所以濃度不是1mol/L,故A錯誤;
B.將溶液加熱濃縮至0.6L,溶液的濃度變為原先的:$\frac{1L}{0.6L}$=$\frac{5}{3}$倍,濃縮后溶液的濃度為:0.5mol/L×$\frac{5}{3}$=$\frac{2.5}{3}$mol/L,故B錯誤;
C.加入10mol/L的NaOH溶液0.1L,再稀釋至1.5L,此時溶液中氫氧化鈉的濃度為:c(NaOH)=$\frac{0.5mol/L×1L+10mol/L×0.1L}{1.5L}$=1mol/L,濃度變為原先的2倍,故C正確;
D.加入1 L 1.5 mol/L的NaOH溶液即加入了1.5mol的NaOH,溶液中NaOH的總物質的量是2mol,但溶液的體積不是2L,所以溶液的濃度不是1mol/L,故D錯誤;
故選C.
點評 本題考查物質的量濃度的計算,題目難度中等,熟練掌握物質的量濃度的概念及表達式為解答關鍵,注意明確溶液稀釋過程中溶質的物質的量不變,試題培養了學生的分析能力及化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1 mol 任何物質所含的分子數均為NA個 | |
| B. | 14 g氮氣所含的N原子數為NA個 | |
| C. | 標準狀況下,22.4 L水所含的H2O分子數為NA個 | |
| D. | 在鈉與氯氣的反應中,1 mol鈉失去電子的數目為2 NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用量筒量取一定體積液體時,俯視讀出的讀數 | |
| B. | 用標準鹽酸滴定未知濃度的NaOH溶液,酸式滴定管未用標準鹽酸潤洗,所測出的堿液的濃度值 | |
| C. | 同一滴定實驗,一般要做三次,取三次實驗的平均值進行計算,但某同學只做了一次 | |
| D. | 達到滴定終點時,俯視讀數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C(SO42-) | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)=C(SO42-)=Ksp½ | |
| D. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NH3•H2O+H+.
NH3•H2O+H+. 2NH3(g)△H=-2a kJ mol-1.
2NH3(g)△H=-2a kJ mol-1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 法國化學家維勒首次提出有機化學的概念;德國化學家貝采里烏斯由氰酸銨合成了尿素,首次打破了有機物和無機物的界限 | |
| B. | 李比希用燃燒法來測定有機化合物中碳氫元素質量分數 | |
| C. | 用核磁共振氫譜和紅外光譜法可以區別乙醇和二甲醚(CH3OCH3) | |
| D. | 用“同位素示蹤法”是研究有機化學反應歷程的手段之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 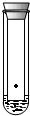 裝置可用于葉綠體中色素的分離 | |
| B. | 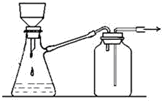 裝置可用于過濾顆粒很小的沉淀,不宜于過濾膠狀沉淀 | |
| C. | 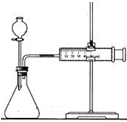 裝置可用于某些化學反應速率的測定.該裝置氣密性的檢查如下:儀器組裝好后,關閉分液漏斗活塞,將針筒活塞向外拉一段距離,然后松手,觀察針筒是否能回到原來刻度處 | |
| D. |  裝置不可用來模擬氯堿工業 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中可能含共價鍵,共價化合物中不含離子鍵 | |
| B. | 共價化合物中可能含離子鍵,離子化合物中只含離子鍵 | |
| C. | 構成單質分子的微粒一定含有共價鍵 | |
| D. | 雙原子分子中的共價鍵,一定是非極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol H2約含有6.02×1023個微粒 | |
| B. | 水的摩爾質量是18g | |
| C. | 氯化氫的摩爾質量就是它的相對分子質量 | |
| D. | 相同物質的量的SO2和SO3,含氧原子個數之比為2:3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com