
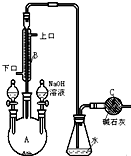
 制備溴苯的實驗裝置如右圖所示,請回答下列問題:
制備溴苯的實驗裝置如右圖所示,請回答下列問題: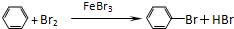 .
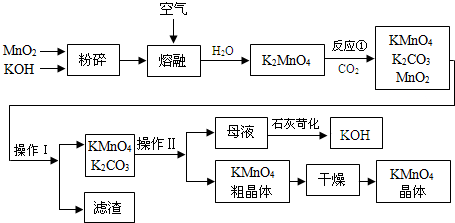
. +Br+→[
+Br+→[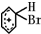 ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3.由上述反應可推知:
+HBr+FeBr3.由上述反應可推知: +Br2→
+Br2→ +HBr 中的催化劑為BD.(填字母)
+HBr 中的催化劑為BD.(填字母)分析 本題是依據苯的性質,用苯和溴為原料制備溴苯,并對反應后的混合物進行分離與提純,得到純凈的溴苯,實驗過程中為了防止溴的揮發,需要要安裝冷凝裝置,冷卻水通常是低進高出,反應后的混合物通常用氫氧化鈉溶液洗滌后再進行分液,因溴苯的密度比水大,分層后應在下層.
(1)該反應裝置中儀器A的名稱為三頸燒瓶,在溴化鐵催化下,苯與液溴反應生成溴苯,裝在左側分液漏斗中的藥品是反應物苯和液溴;
(2)苯與液溴反應生成溴苯的反應方程式;
(3)冷卻水應從下口流入,上口流出,克服重力作用,流速較慢,可達到更好的冷凝效果;
(4)苯與液溴反應放熱,溴易揮發;制備溴苯完成后,加入氫氧化鈉溶液,利用溴和氫氧化鈉反應,將溴苯中的溴除去;
(5)堿石灰吸收尾氣,防止有毒氣體逸出;
(6)催化劑的特征為反應前后質量和性質沒有改變,據此判斷.
解答 解:(1)該反應裝置中儀器A的名稱為三頸燒瓶,在溴化鐵催化下,苯與液溴反應生成溴苯,反應開始前已向儀器A中加入的固體藥品是鐵粉,而裝在左側分液漏斗中的液體藥品是苯、液溴,
故答案為:苯、液溴;
(2)在催化劑的作用下,苯環上的氫原子被溴原子所取代,生成溴苯,同時有溴化氫生成,反應的化學方程式為: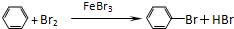 ,
,
故答案為: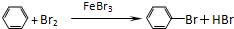 ;
;
(3)冷卻水應從下口流入,上口流出,克服重力,與氣體逆流,流速較慢,可達到更好的冷凝效果,
故答案為:下;
(4)由于反應放熱,苯和液溴均易揮發,溴蒸氣是一種紅棕色的氣體,實驗結束時,打開A下端的活塞,讓反應液流入B中,充分振蕩,目的是使過量的Br2與 NaOH充分反應,可以將溴苯中的溴除去,即Br2+2NaOH=NaBr+NaBrO+H2O,離子反應為2 OH--+Br2═Br-+BrO-+H2O,
故答案為:反應后;Br2+2OH-=Br-+BrO-+H2O;
(5)C中堿石灰的作用是利用堿石灰吸收多余HBr,防止有毒氣體逸出,污染環境,
故答案為:吸收多余HBr,防止污染空氣;
(6)FeBr3、FeBr4-參與了反應,反應前后質量和性質沒有改變,是C6H6+Br2→C6H5Br+HBr中的催化劑,
故答案為:BD.
點評 本題考查了溴苯的制備,題目難度中等,側重考查學生分析問題解決問題的能力,注意掌握苯的取代反應原理,明確反應的產物及HBr的化學性質是解答關鍵,相比于教材中的裝置圖,有所改進.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 反應時間/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反應在0~t1 min內的平均速率為v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他條件不變,起始時向容器中充入0.10molSO3和0.010 molO2,到達平衡時,n(SO2)=0.012 mol | |
| C. | 保持其他條件不變,升高溫度,平衡時c(SO2)=0.0070mol•L-1,則反應的△H>0 | |
| D. | 相同溫度下,起始時向容器中充入0.050molSO2和0.030molO2,達到平衡時SO2轉化率大于88% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
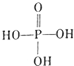
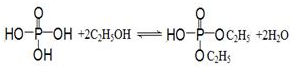 .
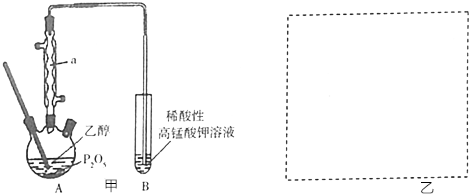
.
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
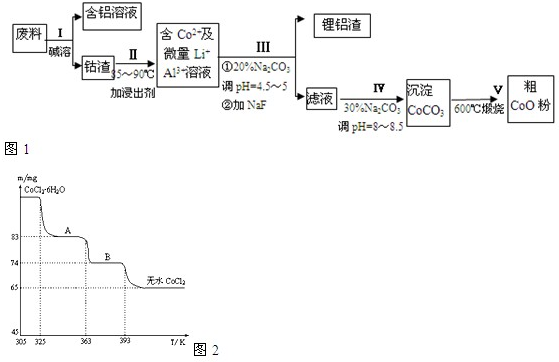
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 亞磷酸二乙酯[HPO(OC2H5)2]為重要的阻燃增塑劑,實驗室采用三氯化磷和無水乙醇制備亞磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;實驗步驟如下:
亞磷酸二乙酯[HPO(OC2H5)2]為重要的阻燃增塑劑,實驗室采用三氯化磷和無水乙醇制備亞磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;實驗步驟如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com