
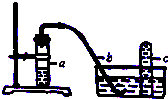
 實驗室用如圖裝置,利用Cu與HNO3反應來制取NO并用排水法收集氣體.
實驗室用如圖裝置,利用Cu與HNO3反應來制取NO并用排水法收集氣體.分析 (1)銅與稀硝酸反應生成硝酸銅、一氧化氮和水;
(2)依據銅質量的減少量計算消耗的硝酸的物質的量,結合速率公式計算;銅與稀硝酸反應,消耗8mol硝酸,其中2mol表現氧化性,6mol表現酸性;
(3)圖中采用排水法收集,收集的氣體不能溶于水;
(4)加熱、增大接觸面積都能夠加快反應速率;
(5)松開拇指后NO與空氣中的氧氣反應:2NO+O2=2NO2,而生成NO2,再投入水中時發生反應:3NO2+H2O=2HNO3+NO,導致氣體體積減小,液面上升,據此解答.
解答 解:(1)銅與稀硝酸反應生成硝酸銅、一氧化氮和水,方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,
故答案為:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(2)消耗的銅的物質的量為$\frac{1.92g}{64g/mol}$=0.03mol,依據方程式:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知消耗硝酸的物質的量為0.08mol,則5min內HNO3的反應速率=$\frac{0.08mol/0.02L}{5min}$=0.8mol/(L•min);銅與稀硝酸反應,消耗8mol硝酸,其中2mol表現氧化性,6mol表現酸性,消耗0.08mol硝酸,被還原的HNO3物質的量為0.02mol;
故答案為:0.8mol/(L•min);0.02mol;
(3)圖中采用排水法收集,收集的氣體不能溶于水,二氧化氮、氨氣、二氧化硫都溶于水,不能用排水法收集,氮氣不溶于水,可以用排水法收集;
故選:c;
(4)加熱、增大接觸面積都能夠加快反應速率,稀釋硝酸,氫離子濃度變小,反應速率減慢,使用濃硝酸反應生成二氧化氮,
故選:AB;
(5)松開拇指后NO與空氣中的氧氣反應:2NO+O2=2NO2,而生成NO2,再投入水中時發生反應:3NO2+H2O=2HNO3+NO,導致氣體體積減小,液面上升,試管內氣體又變為無色,
故答案為:試管內液面上升,氣體恢復成無色.
點評 本題考查了一氧化氮的制備及有關方程式的計算,明確硝酸及氮的氧化物的性質及發生反應是解題關鍵,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
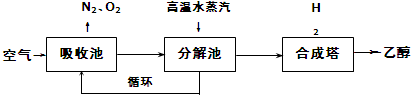
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
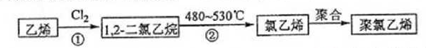
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將SO2通入溴水,溴水褪色 | |
| B. | 將SO2氣體通入滴入有酚酞的NaOH溶液中,紅色褪色 | |
| C. | 將SO2通入品紅溶液中,品紅溶液褪色 | |
| D. | 將SO2通入酸性高錳酸鉀溶液中,溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 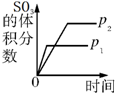 研究壓強對反應的影響(p2>p1) | |
| B. |  研究溫度對反應的影響 | |
| C. |  研究平衡體系中增加O2濃度對反應的影響 | |
| D. |  體積恒定的密閉容器中催化劑對反應的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 室溫下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1鹽酸,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示.下列有關說法錯誤的是( )
室溫下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1鹽酸,溶液pH和溫度隨加入鹽酸體積變化曲線如圖所示.下列有關說法錯誤的是( )| A. | a、d兩點的溶液,水的離子積Kw(a)>Kw(d) | |
| B. | 將此氨水稀釋,溶液的導電能力減弱 | |
| C. | c點時消耗鹽酸體積V(HCl)<20 mL | |
| D. | 室溫下,a點的氨水電離常數為$\frac{1{0}^{2(a-14)}}{1-1{0}^{a-14}}$ mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com