

| 開始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
分析 廢釩催化劑加入亞硫酸鈉、稀硫酸浸泡,然后過濾得到濾渣和濾液,濾液中含有VO2+和Fe2+,向濾液中加入氯酸鉀并調節溶液pH,氯酸鉀具有強氧化性,能將VO2+氧化生成V2O5沉淀,氯酸鉀將亞鐵離子氧化生成鐵離子,然后過濾得到濾液,濾液中含有氯酸鉀、鐵離子、HCl等,將濾渣用NaOH溶液溶解并過濾得到濾渣和含有VO3-溶液,向濾液中加入稀硫酸、硫酸銨,得到濾渣和固體NH4VO3,將NH4VO3焙燒得到V2O5和氨氣,
(1)反應物的接觸面積越大,反應速率越快;
(2)步驟②中VO2+和C1O3-發生氧化還原反應,Cl元素化合價由+5價變為-1價,所以氯酸根離子作氧化劑,則VO2+作還原劑,化合價由+4價變為+5價;
(3)步驟②得到鐵離子,調節溶液的pH使V2O5沉淀但不能使鐵離子產生沉淀;
(4)V2O5和NaOH溶液發生復分解反應生成NaVO3;
(5)硫酸銨溶液呈酸性,步驟④中需加人硫酸,抑制銨根離子水解;
(6)焙燒產生的氣體是氣體,用稀硫酸吸收得到硫酸銨;
(7)V2O5可制成某電池的電解液.該電池的總反應為:VO2++2H++V2+?V3+VO2++H2O,放電時的負極上V2+失電子發生氧化反應.
解答 解:廢釩催化劑加入亞硫酸鈉、稀硫酸浸泡,然后過濾得到濾渣和濾液,濾液中含有VO2+和Fe2+,向濾液中加入氯酸鉀并調節溶液pH,氯酸鉀具有強氧化性,能將VO2+氧化生成V2O5沉淀,氯酸鉀將亞鐵離子氧化生成鐵離子,然后過濾得到濾液,濾液中含有氯酸鉀、鐵離子、HCl等,將濾渣用NaOH溶液溶解并過濾得到濾渣和含有VO3-溶液,向濾液中加入稀硫酸、硫酸銨,得到濾渣和固體NH4VO3,將NH4VO3焙燒得到V2O5和氨氣,
(1)反應物的接觸面積越大,反應速率越快,廢釩催化劑需粉碎處理,目的是增大反應物接觸面積,加快反應速率,故答案為:加快反應速率;
(2)步驟②中VO2+和C1O3-發生氧化還原反應,Cl元素化合價由+5價變為-1價,所以氯酸根離子作氧化劑,則VO2+作還原劑,化合價由+4價變為+5價,轉移電子數是6,反應方程式為6VO2++ClO3-+6H2O=3V2O5↓+Cl-+12H+,
故答案為:6;1;6H2O;3V2O5↓;1;12H+;
(3)步驟②得到鐵離子,調節溶液的pH使V2O5沉淀但不能使鐵離子產生沉淀,結合圖2及鐵離子沉淀需要pH知,調節的pH范圍是2.0-2.5,
故答案為:2.0~2.5;
(4)V2O5和NaOH溶液發生復分解反應生成NaVO3,反應方程式為V2O5+2NaOH=2NaVO3+H2O,
故答案為:V2O5+2NaOH=2NaVO3+H2O;
(5)硫酸銨溶液呈酸性,步驟④中需加人硫酸,抑制銨根離子水解,使NH4+的水解平衡向逆方向移動,增加NH4+的離子濃度,增加NH4VO3的產量,
故答案為:使NH4+的水解平衡向逆方向移動,增加NH4+的離子濃度,增加NH4VO3的產量;
(6)焙燒產生的氣體是氣體,用稀硫酸吸收得到硫酸銨,硫酸銨能循環利用,故答案為:硫酸;
(7)V2O5可制成某電池的電解液.該電池的總反應為:VO2++2H++V2+?V3+VO2++H2O,放電時的負極上V2+失電子發生氧化反應,電極反應式為V2+-e-=V3+,所以產物是V3+,故答案為:V3+.
點評 本題考查物質分離和提純,為高頻考點,涉及原電池原理、鹽類水解、氧化還原反應、反應速率影響因素、基本操作等知識點,綜合性較強,側重考查基本原理,明確流程圖中每一步發生的反應、物質性質及基本操作是解本題關鍵,注意從整體把握分析,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 用藥匙取用粉末狀或顆粒狀固體 | B. | 用膠頭滴管滴加少量液體 | ||
| C. | 傾倒液體時試劑瓶標簽面向手心 | D. | 給盛有$\frac{2}{3}$體積液體的試管加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食用植物油的主要成分是高級不飽和脂肪酸甘油酯 | |
| B. | 福爾馬林可制備標本是利用了使蛋白質變性的性質 | |
| C. | 棉花和蠶絲的主要成分都是纖維素 | |
| D. | 銀氨溶液可以用于區分麥芽糖和蔗糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
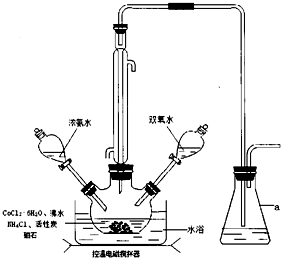
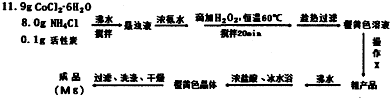
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子序數:C>Li>B | B. | 元素的非金屬性:N>O>F | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 氫化物的穩定性:HF>HCl>HBr |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com