
 降低大氣中CO2的含量及有效地開發利用 CO2,目前工業上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.
降低大氣中CO2的含量及有效地開發利用 CO2,目前工業上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.分析 (1)根據v=$\frac{△c}{△t}$計算;
(2)根據氫氣的平衡濃度判斷轉化的物質的量,進而可計算轉化率;
(3)根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積計算;
(4)要使n(CH3OH)/n(CO2)增大,應使平衡向正反應方向移動.
解答 解:(1)利用三段式解題法計算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
開始(mol/L):1 3 0 0
變化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
從反應開始到平衡,氫氣的平均反應速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案為:0.225;
(2)氫氣的轉化率=$\frac{2.25}{3}$=75%,
故答案為:75%;
(3)平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積,則k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案為:5.33;
(4)要使n(CH3OH)/n(CO2)增大,應使平衡向正反應方向移動,
A.因正反應放熱,升高溫度平衡向逆反應方向移動,則n(CH3OH)/n(CO2)減小,故A錯誤;
B.充入He(g),使體系壓強增大,但對反應物質來說,濃度沒有變化,平衡不移動,n(CH3OH)/n(CO2)不變,故B錯誤;
C.再充入1mol H2,平衡向正反應方法移動,n(CH3OH)/n(CO2)增大,故C正確;
故答案為:C.
點評 本題考查較為綜合,涉及化學平衡計算以及平衡移動等問題,題目難度較大,注意根據圖象計算各物質的平衡濃度為解答該題的關鍵.


科目:高中化學 來源: 題型:選擇題
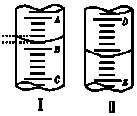 如圖,圖Ⅰ表示10mL量筒中液面的位置,A與B、B與C刻度間相差1mL,圖II表示50mL滴定管中液面的位置,D 與E刻度間相差1mL.如果刻度A和D都是10,則兩處液面的讀數是( )
如圖,圖Ⅰ表示10mL量筒中液面的位置,A與B、B與C刻度間相差1mL,圖II表示50mL滴定管中液面的位置,D 與E刻度間相差1mL.如果刻度A和D都是10,則兩處液面的讀數是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物 質 | 所需試劑 | 離子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 容器編號 | 起始時各物質物質的量/mol | 達到平衡時體系能量的變化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反應的平衡常數均為36 | |
| B. | 容器②中反應達到平衡時放出的熱量為0.05QkJ 達到平衡時,兩個容器中Y2的物質的量濃度均為1.5 mol•L-1 | |
| C. | 向容器①中通入氦氣,平衡時A的轉化率不變 | |
| D. | 其他條件不變,若容器②保持恒容絕熱,則達到平衡時C的體積分數小于$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子云表示電子在核外單位體積的空間出現的機會多少 | |
| B. | 同一原子處于激發態時的能量一定高于基態時的能量 | |
| C. | 各能級包含的原子軌道數按s、p、d、f的順序依次為1、3、5、7 | |
| D. | 1個原子軌道里最多只能容納2個電子,且自旋方向相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com