
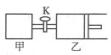
 如圖所示,關閉活塞,向甲、乙兩剛性密閉容器中分別充入1mol A、2mol B,此時甲、乙的容積均為2L(連通管體積忽略不計).在T℃時,兩容器中均發生下述反應:A(g)+2B(g)?2C(g)+3D(g),△H<0.達平衡時,乙的體積為2.6L,下列說法正確的是( )
如圖所示,關閉活塞,向甲、乙兩剛性密閉容器中分別充入1mol A、2mol B,此時甲、乙的容積均為2L(連通管體積忽略不計).在T℃時,兩容器中均發生下述反應:A(g)+2B(g)?2C(g)+3D(g),△H<0.達平衡時,乙的體積為2.6L,下列說法正確的是( )| A. | 甲中反應的平衡常數小于乙 | |
| B. | 當乙中A與B的體積分數之比為1:2時,反應達到平衡狀態 | |
| C. | 平衡時甲容器中A的物質的量小于0.55 mol | |
| D. | 若打開活塞K,達平衡時乙容器的體積為3.2 L |
分析 A.溫度不變,K不變;
B.起始量為1:2,轉化量為1:2;
C.達平衡時,乙的體積為2.6L,由體積比等于物質的量比可知,$\frac{2L}{2.6L}=\frac{3mol}{n}$,n=3.9mol,則
A(g)+2B(g)?2C(g)+3D(g)
開始 1 2 0 0
轉化 x 2x 2x 3x
平衡 1-x 2-2x 2x 3x
1-x+2-2x+2x+3x=3.9,解得x=0.45,
即平衡時A的物質的量為0.55mol,甲保存恒容,相當于乙平衡后加壓,平衡逆向移動;
D.打開活塞K,相當于等壓條件,與原來的乙為等效平衡,反應后總體積為2.6L×2=5.2L.
解答 解:A.溫度不變,K不變,則甲中反應的平衡常數等于乙,故A錯誤;
B.起始量為1:2,轉化量為1:2,則乙中A與B的體積分數之比為1:2時,不能判定平衡狀態,故B錯誤;
C.達平衡時,乙的體積為2.6L,由體積比等于物質的量比可知,$\frac{2L}{2.6L}=\frac{3mol}{n}$,n=3.9mol,則
A(g)+2B(g)?2C(g)+3D(g)
開始 1 2 0 0
轉化 x 2x 2x 3x
平衡 1-x 2-2x 2x 3x
1-x+2-2x+2x+3x=3.9,解得x=0.45,
即平衡時A的物質的量為0.55mol,甲保存恒容,相當于乙平衡后加壓,平衡逆向移動,則平衡時甲中A的物質的量大于0.55mol,故C錯誤;
D.打開活塞K,相當于等壓條件,與原來的乙為等效平衡,反應后總體積為2.6L×2=5.2L,則達平衡時乙容器的體積為5.2L-2L=3.2 L,故D正確;
故選D.
點評 本題考查化學平衡的計算,為高頻考點,把握平衡三段法、K的影響因素、平衡移動為解答的關鍵,側重分析與應用能力的考查,注意等效平衡的判斷,題目難度不大.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下能導電 | B. | 水溶液呈堿性 | ||
| C. | 是共價化合物 | D. | 能與NaOH反應產生NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
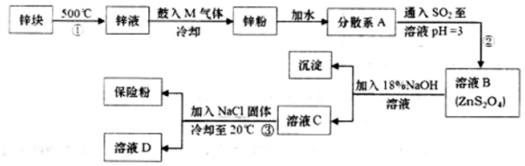
 ;懸濁液; (填“溶液”“膠體”或“懸濁液”).
;懸濁液; (填“溶液”“膠體”或“懸濁液”).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W和X形成的化合物可能含有非極性共價鍵 | |
| B. | X和Z形成的化合物常溫下為固態 | |
| C. | W、X、Y、Z四種元素組成的化合物的水溶液可能呈酸性 | |
| D. | W、X、Y、Z四種元素兩兩之間均能形成二元化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氘原子核外有1個電子 | B. | 氘原子質量數為2 | ||
| C. | 一個氘原子中含有2個中子 | D. | 與氕原子互為同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只生成AgBr及AgI兩種沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com