
【題目】在元素周期表中,除稀有氣體外幾乎所有元素都能與氫形成氫化物,氫化物晶體的結構有共價型和離子型之分。
(1)氨氣是共價型氫化物。工業常用氨氣和醋酸二氨合銅{[Cu(NH3)2]Ac}的混合液來吸收一氧化碳(醋酸根CH3COO-簡寫為Ac-)。反應方程式為:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①寫出銅原子的價電子軌道表示式_________。
②氨分子的空間構型為_________;氨氣極易溶于水是因為_________;氨水中各元素原子的電負性從大到小排列順序為_________。
③醋酸分子中,碳原子的雜化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化學鍵類型有_________。
a 離子鍵b 配位鍵c σ鍵d π鍵
(2)某離子型氫化物化學式為XY2,晶胞結構如圖所示,其中6個Y原子(○)用阿拉伯數字1~6標注。
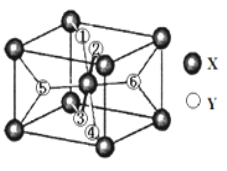
①已知1、2、3、4號Y原子在晶胞上、下面上。則5、6號Y原子均在晶胞__________。(填“側面”或“內部”)
②XY2晶體、硅烷晶體和固態氨3種氫化物熔沸點高低順序正確的是_______。
a XY2晶體>硅烷晶體>固態氨 b XY2晶體>固態氨>硅烷晶體
c 固態氨>硅烷晶體>XY2晶體 d 硅烷晶體>固態氨>XY2晶體
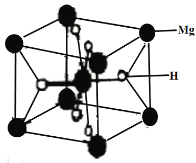
(3)MgH2是金屬氫化物儲氫材料,其晶胞如下圖所示,該晶體的密度為agcm-3,則晶胞的體積為___________cm3(用含a、NA的代數式表示,NA表示阿伏加德羅常數的值)。
【答案】![]() 三角錐形 氨分子和水分子都是極性分子,極性分子易溶于極性溶劑中,且氨分子與水分子可形成分子間氫鍵。 O>N>H sp3、sp2 abcd 內部 b
三角錐形 氨分子和水分子都是極性分子,極性分子易溶于極性溶劑中,且氨分子與水分子可形成分子間氫鍵。 O>N>H sp3、sp2 abcd 內部 b ![]()
【解析】
(1)①由銅的價電子排布式畫出價電子軌道表示式;
②可結合孤對電子、價層電子對數來判斷雜化方式與空間構型。結合相似相溶原理和氫鍵的形成回答氨氣極易溶于水。氨水溶液中含N、O、H三種元素;
③醋酸分子中,碳原子的雜化方式是sp3、sp2 ;
④Cu2+與NH3、CO存在配位鍵,NH3中N與H形成σ鍵,CO中含σ鍵和π鍵,[Cu(NH3)3CO]+與Ac-之間是離子鍵,Ac-中有σ鍵和π鍵;
(2)①由氫化物化學式為XY2以及均攤法計算原子數目可知;
②XY2晶體為離子晶體、硅烷晶體和固態氨為分子晶體;
(3)晶胞的體積=晶胞的質量![]() 晶胞的密度。
晶胞的密度。
(1)①Cu元素為29號元素,原子核外有29個電子,所以電子排布式為:[Ar]3d104s1,價電子排布式為3d104s1,價電子軌道表示式為![]() 。
。
②氨分子中中心氮原子有1對孤電子對,價層電子對數為4,中心原子N的雜化方式為sp3,空間構型為三角錐形。氨氣極易溶于水是因為氨分子和水分子都是極性分子,極性分子易溶于極性溶劑中,且氨分子與水分子可形成分子間氫鍵。氨水溶液中含N、O、H三種元素,氫的電負性最小,又由同周期自左而右電負性增大,故電負性從大到小的排列順序為O>N>H;
③醋酸分子中甲基(-CH3)中C原子形成4個σ鍵,C上沒有孤電子對,價層電子對數為4,采用sp3雜化,羧基(-COOH)中碳原子形成3個σ鍵,C上沒有孤電子對,價層電子對數為3,采用sp2雜化,故答案為:sp3;sp2 ;
④Cu2+與NH3、CO存在配位鍵,NH3中N與H形成σ鍵,CO中含σ鍵和π鍵,[Cu(NH3)3CO]+與Ac-之間是離子鍵,Ac-中有σ鍵和π鍵,即存在的化學鍵類型為:配位鍵、σ鍵、π鍵和離子鍵,故選:abcd;
(2)①X位于8個頂點和體心,晶胞中一共含2個X,則由氫化物化學式為XY2,則該晶胞中含4個Y,又1、2、3、4號Y原子在晶胞上、下面上,則實際為2個Y原子,則5、6號Y原子均在晶胞內部,故答案為:內部;
②XY2晶體為離子晶體、硅烷晶體和固態氨為分子晶體,所以XY2晶體熔沸點最高,而固態氨中氨分子間存在氫鍵,所以固態氨的熔沸點比硅烷晶體高,故選:b。
(3)Mg位于頂點和體心,數目為8×![]() +1=2,H位于面心,數目為:8×
+1=2,H位于面心,數目為:8×![]() =4,則晶胞質量為
=4,則晶胞質量為![]() g,晶胞體積為:
g,晶胞體積為:![]() cm3。
cm3。


科目:高中化學 來源: 題型:
【題目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序數依次增大,
原子序數依次增大,![]() 與
與![]() 同主族但最高化合價不同,
同主族但最高化合價不同,![]() 是金屬性最強的短周期元素。下列說法不正確的是( )。
是金屬性最強的短周期元素。下列說法不正確的是( )。
A.簡單離子半徑:![]()
B.最高價氧化物對應水化物的酸性:![]()
C.化合物![]() 能與水劇烈反應,產生白霧并放出具有刺激性氣味的氣體
能與水劇烈反應,產生白霧并放出具有刺激性氣味的氣體
D.![]() 的氣態氫化物通入
的氣態氫化物通入![]() 水溶液中產生淡黃色沉淀并放出有刺激性氣味的氣體
水溶液中產生淡黃色沉淀并放出有刺激性氣味的氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe+H2SO4=FeSO4+H2↑的能量變化趨勢如圖所示:
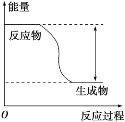
(1)該反應為_____(填“吸熱”或“放熱”)反應。
(2)若要使該反應的反應速率加快,下列措施可行的是_____(填字母)。
A.改鐵片為鐵粉 B.改稀硫酸為98%的濃硫酸 C.升高溫度
(3)若將上述反應設計成原電池,銅為原電池某一極材料,則銅為_____(填“正”或“負”)極。銅片上的現象為_____,該極上發生的電極反應為_____,外電路中電子由_____移動。(填“正極向負極”或“負極向正極”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的利用是我國能源領域的一個重要戰略方向,目前我國科學家在以下方面已經取得重大成果。
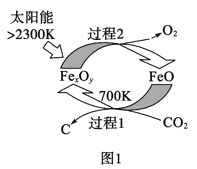
(1)圖1是由CO2制取C的太陽能工藝。已知過程1發生的反應中![]() =6,則FexOy的化學式為__。過程1生成1molC的反應熱為△H1;過程2產生lmolO2(g)的反應熱為△H2。則由CO2制取C的熱化學方程式為__。
=6,則FexOy的化學式為__。過程1生成1molC的反應熱為△H1;過程2產生lmolO2(g)的反應熱為△H2。則由CO2制取C的熱化學方程式為__。
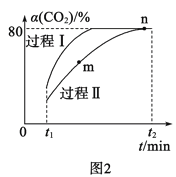
(2)利用CO2合成甲醇的反應為:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定條件下,將1molCO2和2.8molH2充入容積為2L的絕熱密閉容器中,發生上述反應。CO2的轉化率[α(CO2)]在不同催化劑作用下隨時間的變化曲線如圖2所示。過程Ⅰ的活化能__(填“>”“<”或“=”)過程Ⅱ的活化能,n點的平衡常數K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定條件下,將1molCO2和2.8molH2充入容積為2L的絕熱密閉容器中,發生上述反應。CO2的轉化率[α(CO2)]在不同催化劑作用下隨時間的變化曲線如圖2所示。過程Ⅰ的活化能__(填“>”“<”或“=”)過程Ⅱ的活化能,n點的平衡常數K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以納米二氧化鈦膜為工作電極,常溫常壓電解CO2,可制得LDPE,該電極反應可能的機理如圖3所示。
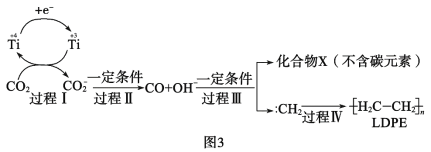
①過程Ⅰ~Ⅲ中碳元素發生__反應(填“氧化”或“還原”)。
②請補充完整并配平CO2轉化為LDPE的電極反應:2nCO2+___+___=![]() +___。__
+___。__
③工業上生產1.4×104g的LDPE,理論上需要標準狀況下CO2的體積是__L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學反應中,不屬于四種基本反應類型的是( )
A.2HCl+CaCO3=CaCl2+H2O+CO2↑B.2FeCl3+Cu=2FeCl2+CuCl2
C.2KMnO4![]() K2MnO4+MnO2+O2↑D.Na2O+H2O=2NaOH
K2MnO4+MnO2+O2↑D.Na2O+H2O=2NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今年是俄羅斯化學家門捷列夫提出“元素周期律”150周年。門捷列夫為好幾種當時尚未發現的元素(如“類鋁”“類硅”和“類硼”)留下了空位。而法國科學家在1875年研究閃鋅礦(ZnS)時發現的“鎵”,正是門捷列夫預言的“類鋁”,其性質也是和預言中的驚人相似。請回答下列問題:
(1)①基態鎵原子中,核外存在__________對自旋相反的電子,核外電子占據的最高能級的電子云輪廓圖為__________形;門捷列夫預言的“類硼”就是現在的鈧,“類硅”即是現在的鍺。在鎵、鈧、鍺三種元素的原子中,未成對電子數最多的是_________ (填元素符號)。
②下列說法中,最有可能正確的一項是_________(填字母代號)。
A 類鋁在100℃時蒸氣壓很高 B 類鋁的氧化物一定不能溶于強堿溶液
C 類鋁一定不能與沸水反應 D 類鋁能生成類似明礬的礬類
(2)氯化鎵晶體熔點為77.9℃。氯化鎵分子中鎵的雜化方式為_______,空間構型為_______;寫出與氯化鎵互為等電子的的分子、離子各一種:_______、_______。
(3)GaN、GaP、GaAs都是很好的半導體材料,晶體類型與晶體硅類似,GaN、GaP、GaAs晶體的熔點如下表所示,分析其變化原因:__________________。
GaN | GaP | GaAs | |
熔點 | 1700℃ | 1480℃ | 1238℃ |
(4)2011年,我國將鎵列為戰略儲備金屬,我國的鎵儲量約占世界儲量的80%以上。砷化鎵也是半導體材料,其結構與硫化鋅類似,其晶胞結構如下圖所示:

①原子坐標參數是晶胞的基本要素之一,表示晶胞內部各原子的相對位置。圖中A(0,0,0)、B(![]() )、C(1,
)、C(1,![]() ,
,![]() ),則此晶胞中,距離A球最遠的黑球的坐標參數為______________。
),則此晶胞中,距離A球最遠的黑球的坐標參數為______________。
②若砷和鎵的原子半徑分別為a cm和b cm,砷化鎵的摩爾質量為M g/mol,密度為![]() g/cm3,晶胞中原子體積占空間體積百分率(即原子體積的空間占有率)為_________ (用含a、b、M、
g/cm3,晶胞中原子體積占空間體積百分率(即原子體積的空間占有率)為_________ (用含a、b、M、![]() 、NA的代數式表示,NA表示阿伏加德羅常數的值)。
、NA的代數式表示,NA表示阿伏加德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將 0.10 mol·L-1 鹽酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 隨加入鹽酸體積變化曲線如圖所示。已知:pOH=-lg c(OH-),下列正確的是

A. M 點所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 點所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 點鹽酸與氨水恰好中和
D. M 點到Q點所示溶液中水的電離程度先變大后減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A.氨水中通入過量的SO2:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
B.大理石與醋酸反應:CaCO3+2H+ =Ca2+ + H2O + CO2↑
C.向熱的稀硫酸中加入銅粉并鼓入空氣:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D.碳酸氫鈉溶液和過量氫氧化鋇溶液混合:2HCO3-+ Ba2+ + 2OH-== BaCO3↓+ CO32- + 2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下,Ksp(ZnS)=1.6×10-24;pM=-lgc(M2+)(M2+為Cu2+或Zn2+)。常溫下,向10mL0.10mol·L-1CuCl2溶液中滴加0.10mol·L-1Na2S溶液,滴加過程中pM與Na2S溶液體積(V)的關系如圖所示。下列說法錯誤的是

A.Ksp(CuS)的數量級為10-36
B.a點溶液中,c(Na+)=2[c(S2-)+c(HS-)+c(H2S)]
C.d點溶液中:c(Na+)>c(Cl-)>c(S2-)>c(H+)
D.相同條件下,若用等濃度等體積的ZnCl2溶液代替上述CuCl2溶液,則反應終點c向上移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com