
【題目】二氧化碳的利用是我國能源領域的一個重要戰略方向,目前我國科學家在以下方面已經取得重大成果。
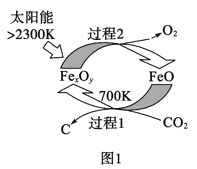
(1)圖1是由CO2制取C的太陽能工藝。已知過程1發生的反應中![]() =6,則FexOy的化學式為__。過程1生成1molC的反應熱為△H1;過程2產生lmolO2(g)的反應熱為△H2。則由CO2制取C的熱化學方程式為__。
=6,則FexOy的化學式為__。過程1生成1molC的反應熱為△H1;過程2產生lmolO2(g)的反應熱為△H2。則由CO2制取C的熱化學方程式為__。
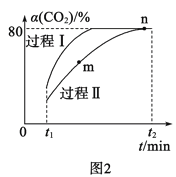
(2)利用CO2合成甲醇的反應為:CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定條件下,將1molCO2和2.8molH2充入容積為2L的絕熱密閉容器中,發生上述反應。CO2的轉化率[α(CO2)]在不同催化劑作用下隨時間的變化曲線如圖2所示。過程Ⅰ的活化能__(填“>”“<”或“=”)過程Ⅱ的活化能,n點的平衡常數K=__。
H2O(g)+CH3OH(g) ΔH=-53.7kJ·mol-1,一定條件下,將1molCO2和2.8molH2充入容積為2L的絕熱密閉容器中,發生上述反應。CO2的轉化率[α(CO2)]在不同催化劑作用下隨時間的變化曲線如圖2所示。過程Ⅰ的活化能__(填“>”“<”或“=”)過程Ⅱ的活化能,n點的平衡常數K=__。
(3)用二氧化碳合成低密度聚乙烯(LDPE)。以納米二氧化鈦膜為工作電極,常溫常壓電解CO2,可制得LDPE,該電極反應可能的機理如圖3所示。
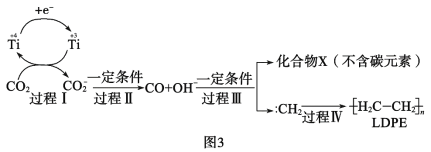
①過程Ⅰ~Ⅲ中碳元素發生__反應(填“氧化”或“還原”)。
②請補充完整并配平CO2轉化為LDPE的電極反應:2nCO2+___+___=![]() +___。__
+___。__
③工業上生產1.4×104g的LDPE,理論上需要標準狀況下CO2的體積是__L。
【答案】Fe3O4 CO2(g)=C(s)+O2(g) △H=△H1+△H2 < 200 還原 2nCO2+12ne-+12nH+=![]() +4nH2O 2.24×104
+4nH2O 2.24×104
【解析】
(1)根據![]() =6可寫出反應的化學方程式:6FeO+CO2===FexOy+C,根據原子守恒知x∶y=3∶4;由蓋斯定律計算可得;
=6可寫出反應的化學方程式:6FeO+CO2===FexOy+C,根據原子守恒知x∶y=3∶4;由蓋斯定律計算可得;
(2)反應活化能越小,反應速率越快;由題意可以建立三段式計算可得熱化學方程式;
(3)①由題給示意圖可知,過程Ⅰ~Ⅲ中碳元素發生如下轉化CO2→CO2-→CO→∶CH2,碳元素的化合價的變化為+4→+3→+2→-2;
②CO2轉化為LDPE時碳元素的化合價由+4降到-2價,每個碳原子得6個電子,則2n個CO2共得12n個電子;
③據2nCO2~![]() 計算可得標準狀況下CO2的體積。
計算可得標準狀況下CO2的體積。
(1)根據![]() =6可寫出反應的化學方程式:6FeO+CO2===FexOy+C,根據原子守恒知x∶y=3∶4,則FexOy的化學式為Fe3O4;由蓋斯定律可知,過程1+過程2可得CO2制取C的熱化學方程式CO2(g)=C(s)+O2(g),則△H=△H1+△H2,故答案為:Fe3O4;CO2(g)=C(s)+O2(g) △H=△H1+△H2;
=6可寫出反應的化學方程式:6FeO+CO2===FexOy+C,根據原子守恒知x∶y=3∶4,則FexOy的化學式為Fe3O4;由蓋斯定律可知,過程1+過程2可得CO2制取C的熱化學方程式CO2(g)=C(s)+O2(g),則△H=△H1+△H2,故答案為:Fe3O4;CO2(g)=C(s)+O2(g) △H=△H1+△H2;
(2)反應活化能越小,反應速率越快,由題給示意圖可知,過程Ⅰ先達到平衡,反應速率快于過程Ⅱ,則過程Ⅰ的活化能小于過程Ⅱ的活化能;由圖可知CO2的轉化率為80%,反應消耗二氧化碳的濃度為0.4mol/L,由題意可以建立如下三段式:

則平衡常數K=![]() =200,故答案為:<;200;
=200,故答案為:<;200;
(3)①由題給示意圖可知,過程Ⅰ~Ⅲ中碳元素發生如下轉化CO2→CO2-→CO→∶CH2,碳元素的化合價的變化為+4→+3→+2→-2,均為碳被還原的過程,故碳元素均發生還原反應,故答案為:還原;
②CO2轉化為LDPE時碳元素的化合價由+4降到-2價,每個碳原子得6個電子,則2n個CO2共得12n個電子,電極反應反應式為2nCO2+12ne-+12nH+=![]() +4nH2O,故答案為:2nCO2+12ne-+12nH+=
+4nH2O,故答案為:2nCO2+12ne-+12nH+=![]() +4nH2O;
+4nH2O;
③生產1.4×104 g ![]() ,即生產1.4×104g
,即生產1.4×104g![]() ,據2nCO2~
,據2nCO2~![]() ,可知CO2的物質的量為
,可知CO2的物質的量為![]() =1.0×103mol,標準狀況下CO2的體積等于1.0×103mol×22.4L/mol=2.24×104L,故答案為:2.24×104。
=1.0×103mol,標準狀況下CO2的體積等于1.0×103mol×22.4L/mol=2.24×104L,故答案為:2.24×104。


科目:高中化學 來源: 題型:
【題目】常溫下,向1 L 0.1 mol·L-1一元酸HR溶液中逐漸通入氨氣[已知常溫下NH3·H2O電離平衡常數K=1.76×10-5],使溶液溫度和體積保持不變,混合溶液的pH與離子濃度變化的關系如下圖所示。下列敘述正確的是

A. 0.1 mol·L-1 HR溶液的pH為5
B. HR為弱酸,常溫時隨著氨氣的通入,c(R-)/[c(OH-).c(HR)] 逐漸增大
C. 當通入0.1 mol NH3時,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 當c(R-)= c(HR)時,溶液必為中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,分別向濃度均為0.1 mol/L,體積均為20 mL的HX和HY的溶液中滴入等物質的量濃度的氨水,溶液中水電離出的c(H+)與加入氨水的體積變化關系如圖所示。下列說法正確的是
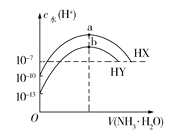
A. HX的電離方程式為HX![]() H++X
H++X
B. b點時溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的電離平衡常數約為1×107 mol/L
D. a、b兩點對應溶液中存在的微粒種類數目相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2022年前后我國將建成首座載人空間站。為實現空間站的零排放,循環利用人體呼出的CO2并提供O2,我國科學家研發了一種能量轉化裝置,總反應方程式為2CO2=2CO+O2。下列說法正確的是( )

A.該裝置將太陽能直接轉化為化學能
B.離子交換膜為陽離子交換膜
C.反應完畢,該裝置中電解質溶液的pH不變
D.Y電極的反應:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據電解飽和食鹽水的實驗內容填寫:
(1) 陽極與電源的__極(選填正或負)相連;陽極產生_(填化學式)氣體;它的檢驗方法是__。
(2)陽極發生___反應;陰極發生__反應(選填氧化或還原)。
查看答案和解析>>
科目:高中化學 來源: 題型:
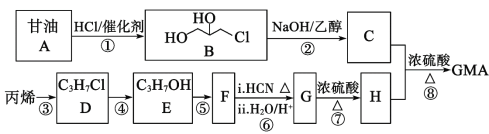
【題目】甲基丙烯酸甘油酯GMA(![]() ),由于本身帶有丙烯酸酯雙鍵和環氧基團,使得其應用十分廣泛。工業合成GMA的一種方法如圖(部分反應所需試劑和條件已略去):
),由于本身帶有丙烯酸酯雙鍵和環氧基團,使得其應用十分廣泛。工業合成GMA的一種方法如圖(部分反應所需試劑和條件已略去):
已知:
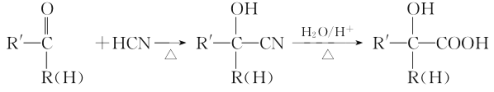
請按要求回答下列問題:
(1)B中的官能團名稱:__;
(2)C的結構簡式__;
(3)請寫出E→F的反應方程式和反應類型:E→F:__,__反應;
(4)H的核磁共振氫譜峰面積之比由大到小為__,H的同分異構體中能發生水解反應的鏈狀化合物有__種。
(5)已知:CH2=CH2![]()
![]() 。參照上述合成路線并結合此信息,以丙烯為原料,完善下列合成有機物C的路線流程圖:
。參照上述合成路線并結合此信息,以丙烯為原料,完善下列合成有機物C的路線流程圖:![]()
![]() __。
__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中,除稀有氣體外幾乎所有元素都能與氫形成氫化物,氫化物晶體的結構有共價型和離子型之分。
(1)氨氣是共價型氫化物。工業常用氨氣和醋酸二氨合銅{[Cu(NH3)2]Ac}的混合液來吸收一氧化碳(醋酸根CH3COO-簡寫為Ac-)。反應方程式為:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①寫出銅原子的價電子軌道表示式_________。
②氨分子的空間構型為_________;氨氣極易溶于水是因為_________;氨水中各元素原子的電負性從大到小排列順序為_________。
③醋酸分子中,碳原子的雜化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化學鍵類型有_________。
a 離子鍵b 配位鍵c σ鍵d π鍵
(2)某離子型氫化物化學式為XY2,晶胞結構如圖所示,其中6個Y原子(○)用阿拉伯數字1~6標注。
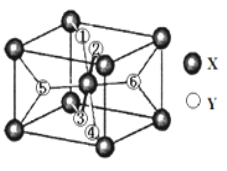
①已知1、2、3、4號Y原子在晶胞上、下面上。則5、6號Y原子均在晶胞__________。(填“側面”或“內部”)
②XY2晶體、硅烷晶體和固態氨3種氫化物熔沸點高低順序正確的是_______。
a XY2晶體>硅烷晶體>固態氨 b XY2晶體>固態氨>硅烷晶體
c 固態氨>硅烷晶體>XY2晶體 d 硅烷晶體>固態氨>XY2晶體
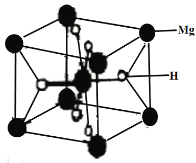
(3)MgH2是金屬氫化物儲氫材料,其晶胞如下圖所示,該晶體的密度為agcm-3,則晶胞的體積為___________cm3(用含a、NA的代數式表示,NA表示阿伏加德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為一種利用原電池原理設計測定O2含量的氣體傳感器示意圖,RbAg4I5是只能傳導Ag+的固體電解質。O2可以通過聚四氟乙烯膜與AlI3 反應生成Al2O 3和I2,通過電池電位計的變化可以測得O2的含量。下列說法正確的是( )

A. 正極反應為:3O2+12e-+4Al3+=2Al2O3
B. 傳感器總反應為:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外電路轉移0.01mol電子,消耗O2的體積為0.56L
D. 給傳感器充電時,Ag+向多孔石墨電極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究碳、氮、硫等元素化合物的性質或轉化對建設生態文明、美麗中國具有重要意義。
(1)海水中無機碳的存在形式及分布如下圖所示:用離子方程式表示海水呈弱堿性的原因_________。己知春季海水pH=8.1,預測夏季海水堿性將會_________(填寫“增強”或“減弱”),理由是________(寫出1條即可)
無機碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3僅為CO2的0.2% | ||
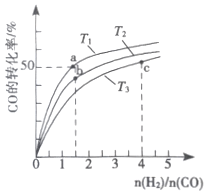
(2)工業上以CO和H2為原料合成甲醇的反應:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容積為1L 的恒容容器中,分別在T1、T2、T3三種溫度下合成甲醇。如圖是上述三種溫度下不同H2和CO的 起始組成比(起始時CO的物質的量均為lmol)與CO平衡轉化率的關系。下列說法正確的是_________(a、b點橫坐標相同,a在曲線T1上,b在曲線T2上)
CH3OH(g) △H<0,在容積為1L 的恒容容器中,分別在T1、T2、T3三種溫度下合成甲醇。如圖是上述三種溫度下不同H2和CO的 起始組成比(起始時CO的物質的量均為lmol)與CO平衡轉化率的關系。下列說法正確的是_________(a、b點橫坐標相同,a在曲線T1上,b在曲線T2上)
A.a、b、c三點H2轉化率:c>a>b
B.上述三種溫度之間關系為T1>T2>T3
C.a點(1.5,50)狀態下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移動
D.c點狀態下再通入1 molCO和4molH2,新平衡中H2的體積分數增大
(3)NO加速臭氧層被破壞,其反應過程如圖所示:
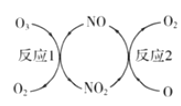
①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反應 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反應2:熱化學方程式為______________________。
(4)近年來,地下水中的氮污染己成為一個世界性的環境問題。在金屬Pt、Cu和銥(Ir)的催化作用 下,密閉容器中的H2可髙效轉化酸性溶液中的硝態氮(NO3-)從而降低水體中的氮含量,其工作原理如下圖所示
①Ir表面發生反應的方程式為__________________________。
②若導電基體上的Pt顆粒增多,造成的后果是__________________________。

(5)利用電化學原理,將NO2、O2和熔融KNO3制成燃料電池,模擬工業電解法來精煉銀,裝置如圖所示,甲池工作時,NO2轉變成綠色硝化劑Y,Y是N2O5,可循環使用,則石墨II附近發生的電極反應式為__________________________。
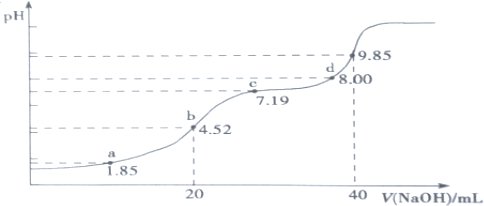
(6)大氣污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃時,H2SO3 的 pKa1=1.85, pKa2=7.19。該溫度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲線如下圖所示。b點所得溶液中各離子濃度由大到小的順序是__________________________;c點所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com