
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水電離的c(OH-)相等 | |
| B. | 常溫下將醋酸鈉、鹽酸兩溶液混合后,溶液呈中性,則混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常溫下物質的量濃度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三種溶液中NH4+的濃度:②>③>① | |
| D. | 等體積等物質的量濃度的NaClO(aq)與NaCl(aq)中離子總數:N前>N后 |
分析 A.Ba(OH)2為強堿抑制水的電離,Na2C03為強堿弱酸鹽水解促進水的電離;
B.將醋酸鈉,鹽酸兩溶液混合,二者之間反應生成氯化鈉和醋酸,溶液呈中性,則醋酸鈉會剩余,根據電荷守恒和物料守恒知識來回答;
C.碳酸根離子促進銨根離子水解、亞鐵離子抑制銨根離子水解,銨根離子水解程度越大,溶液中c(NH4+)越小;
D.根據電荷守恒可知NaClO(aq)中c(Na+)+c(H+)=c(OH-)+c(ClO-),所以次氯酸鈉溶液中離子總濃度為2[c(Na+)+c(H+)],根據電荷守恒可知氯化鈉溶液中離子總濃度也為2[c(Na+)+c(H+)],結合溶液中氫離子濃度大小判斷.NaClO發生水解,溶液中次氯酸根水解,溶液呈堿性,所以c(OH-)>c(H+),等物質的量濃度的NaClO(aq)與NaCl(aq)中,次氯酸鈉溶液中氫離子濃度小于NaCl(aq)中氫離子濃度.
解答 解:A.水的電離方程式為H2O?H++OH-,Ba(OH)2為強堿水的電離,Na2C03為強堿弱酸鹽促進水的電離,因此Na2C03溶液中水電離的c(OH-)大,故A錯誤;
B.原來只有醋酸鈉加入的鹽酸沒有醋酸根離子也沒有鈉離子,即n(Na+)=n(CH3COOH)+n(CH3COO-),因此:①C(Na+)=C(CH3COOH)+C(CH3COO-);
因為顯中性:c(H+)=c(OH-)從電荷守恒可知:C(Na+)+C(H+)=C(CH3COO-)+C(Cl-)+C(OH-),于是②C(Na+)=C(CH3COO-)+C(Cl-),因此C(Na+)>C(Cl-),然后把①代入②式,消去C(Na+)得c(Cl-)=c(CH3COOH),因此得出C(Na+)>C(Cl-)=c(CH3COOH),故B錯誤;
C.①NH4HCO3中NH4+水解呈酸性,HCO3-水解呈堿性,它促進NH4+的水解;②NH4HSO4中HSO4-在水溶液中完全電離產生H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解產生H+的濃度小,它對抑制NH4+的水解抑制程度小,所以三種溶液中c(NH4+):①<③<②,故C正確;
D.根據電荷守恒可知NaClO(aq)中c(Na+)+c(H+)=c(OH-)+c(ClO-),所以次氯酸鈉溶液中離子總濃度為2[c(Na+)+c(H+)],根據電荷守恒可知氯化鈉溶液中離子總濃度也為2[c(Na+)+c(H+)],NaClO發生水解,溶液中次氯酸根水解,溶液呈堿性,所以c(OH-)>c(H+),等物質的量濃度的NaClO(aq)與NaCl(aq)中,次氯酸鈉溶液中c(H+)小于NaCl(aq)中c(H+),兩溶液中c(Na+)相同,所以.等體積等物質的量濃度的NaClO(aq)與NaCl(aq)中離子總數多少:N前<N后,故D錯誤;
故選C.
點評 本題考查離子濃度大小比較,明確溶質的性質確定溶液酸堿性,再結合守恒思想、靈活應用電荷守恒式、微粒守恒、質子恒等式分析解答,注意(2)離子之間的相互影響,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Al2O3熔點很高,可用作熔融NaOH的坩堝材料 | |
| B. | 明礬能水解生成Al(OH)3膠體,可用作凈水劑 | |
| C. | 鎂在空氣中燃燒發出耀眼的白光,可用于制作照明彈 | |
| D. | 日用鋁制品表面覆蓋著氧化膜,對內部金屬起保護作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  插入海水中的鐵棒,越靠近底端腐蝕越嚴重 | |
| B. |  插入溶液中的鐵棒容易溶解,主要是發生電化學腐蝕 | |
| C. |  燃氣灶的中心部位容易生銹,主要是由于高溫下鐵發生化學腐蝕 | |
| D. |  用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的陰極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe、Mg.Al均能與空氣中的氧氣反應在表面生成致密的氧化膜,對內層金屬有保護作用 | |
| B. | Fe在高溫下能與水蒸氣反應,Fe被氧化生成Fe2O3,H2O被還原生成H2 | |
| C. | 鑒別Na2CO3和NaHCO3溶液可向兩種溶液中加入Ba(OH)2溶液,產生沉淀的就是Na2CO3 | |
| D. | Al與NaOH溶液的反應中,NaOH既不是氧化劑又不是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 $\stackrel{催化劑}{→}$
$\stackrel{催化劑}{→}$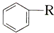 +HCl
+HCl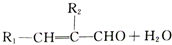
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中毒反應中亞硝酸鹽是氧化劑 | |
| B. | 維生素C能將Fe3+氧化為Fe2+,使其解毒 | |
| C. | 中毒反應中Fe3+是還原產物 | |
| D. | 維生素C能將亞硝酸鹽氧化成硝酸鹽,使其解毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在1mol CaC2、KHSO4、Na2O2三種離子化合物中,所含陰、陽離子的總數均為3NA | |
| B. | 1molCu和足量熱濃硫酸反應可生成nA個SO3分子 | |
| C. | 3mol單質Fe完全轉變為Fe3O4,失去8nA個電子 | |
| D. | 78gNa2O2與足量水反應轉移的電子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O2的氧化性比Fe3+強,其還原性比Fe2+弱 | |
| B. | 在H2O2分解過程中,溶液的酸性增強 | |
| C. | H2O2分解的總方程式為:H2O2═H2O+O2↑ | |
| D. | H2O2生產過程要嚴格避免混入Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com