
【題目】某有機物的結構簡式如圖所示,下列說法中不正確的是( )
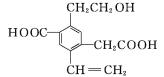
A.1 mol該有機物和過量的金屬鈉反應最多可以生成1.5 mol H2
B.該有機物最多消耗Na、NaOH、NaHCO3的物質的量之比為3∶2∶2
C.可以用酸性KMnO4溶液檢驗其中的碳碳雙鍵
D.該有機物能夠在催化劑作用下發生酯化反應
【答案】C
【解析】
A.1mol-OH和鈉反應生成0.5mol的氫氣,2mol-COOH和鈉反應生成1mol的氫氣,1 mol該有機物和過量的金屬鈉反應最多可以生成1.5 mol H2,正確,A不符合題意;
B.1mol羥基和2mol羧基共消耗3mol鈉,2mol羧基共消耗2molNaOH,2mol羧基共消耗2molNaHCO3,所以該有機物最多消耗Na、NaOH、NaHCO3的物質的量之比為3∶2∶2
正確,B不符合題意;
C.結構中的醇羥基,苯環的側鏈均能和酸性高錳酸鉀反應,所以不能用酸性KMnO4溶液檢驗其中的碳碳雙鍵,錯誤,C符合題意;
D.該有機物含有-OH和-COOH,能夠在催化劑作用下與酸發生酯化反應,正確,D不符合題意。
答案選C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】草酸是一種常用的還原劑,某校高三化學小組探究草酸被氧化的速率問題。
實驗Ⅰ | 試劑 | 混合后 溶液pH | 現象 (1 h后溶液) | ||
試管 | 滴管 | ||||
| a | 4mL0.01molL-1KMnO4溶液,幾滴濃H2SO4 | 2 mL0.3molL-1 H2C2O4溶液 | 2 | 褪為無色 |
b | 4mL0.01molL-1KMnO4溶液,幾滴濃NaOH | 7 | 無明顯變化 | ||
c | 4mL0.01molL-1K2Cr2O7溶液,幾滴濃H2SO4 | 2 | 無明顯變化 | ||
d | 4mL0.01molL-1K2Cr2O7溶液,幾滴濃NaOH | 7 | 無明顯變化 | ||
(1)H2C2O4是二元弱酸,寫出H2C2O4溶于水的電離方程式:___________。
(2)實驗Ⅰ試管a中KMnO4最終被還原為Mn2+,該反應的離子方程式為__________。
(3)瑛瑛和超超查閱資料,實驗Ⅰ試管c中H2C2O4與K2Cr2O7溶液反應需數月時間才能完成,但加入MnO2可促進H2C2O4與K2Cr2O7的反應。依據此資料,吉吉和昊昊設計如下實驗證實了這一點。
實驗Ⅱ | 實驗Ⅲ | 實驗Ⅳ | |
實驗 操作 |
|
|
|
實驗 現象 | 6min后固體完全溶解,溶液橙色變淺,溫度不變 | 6min后固體未溶解,溶液顏色無明顯變化 | 6min后固體未溶解,溶液顏色無明顯變化 |
實驗Ⅳ的目的是:_______________。
(4)睿睿和萌萌對實驗II繼續進行探究,發現溶液中Cr2O72-濃度變化如圖:

臧臧和蔡蔡認為此變化是通過兩個過程實現的。
過程i:MnO2與H2C2O4反應生成了Mn2+。
過程ii:___________。
①查閱資料:溶液中Mn2+能被PbO2氧化為MnO4-。針對過程i,可采用如下方法證實:將0.0001mol MnO2加入到6mL______中,固體完全溶解;從中取出少量溶液,加入過量PbO2固體,充分反應后靜置,觀察到________________。
②波波和姝姝設計實驗方案證實了過程ii成立,她們的實驗方案如下:將2mL、0.3mol/LH2C2O4溶液與4mL0.01mol/LK2Cr2O7溶液混合,調至pH=2,加入0.0001molMnSO4固體,6分鐘后現象為:______________
(5)綜合以上實驗可知,草酸發生氧化反應的速率與____________有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關有機化合物的說法錯誤的是
A.葡萄糖和淀粉互為同系物
B.植物油含不飽和脂肪酸甘油酯,與氫氣加成后生成固態的人造脂肪
C.對三聯苯(![]() )分子中在同一直線上的原子最多有8個
)分子中在同一直線上的原子最多有8個
D.分子式為C7H16的烷烴,最長碳鏈上有5個碳原子的同分異構體共有5種(不含立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬釩(V)及其化合物有著廣泛的用途。請回答以下問題:
(1)釩在溶液中的主要聚合狀態與溶液的pH關系如圖1所示。V2O74-中V元素的化合價是_____,請寫出溶液中VO3-轉化為V2O74-的離子方程式:________________________。
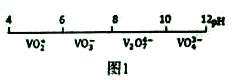
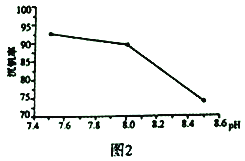
(2)“弱堿性銨鹽沉釩法”原理是在含有釩元素的溶液中加入銨鹽后形成NH4VO3沉淀,圖2是在工業生產中不同pH環境下沉釩率的測定值。實際工業生產中常選擇pH=7.5為沉釩的最佳條件,當pH超過8.0時沉釩率降低,其原因是溶液中VO3-轉化為V2O74-、____________________________________。(請另寫出一點原因)
(3)NH4VO3在高溫下分解產生的V2O5可作為硫酸工業中2SO2(g)+O2(g) ![]() 2SO3(g) △H=p的催化劑,其催化原理如圖3所示。
2SO3(g) △H=p的催化劑,其催化原理如圖3所示。
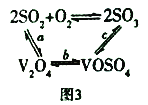
①過程a和過程b的化學方程式為:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 請寫出過程c的熱化學方程式:_________________。
②t2℃下,反應:2SO3(g) ![]() 2SO2(g)+O2(g)△H>0;SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖所示。
2SO2(g)+O2(g)△H>0;SO3的平衡轉化率(a)與體系總壓強(p)的關系如圖所示。

t℃下,將2molSO3置于10L密閉容器中,反應達平衡后,體系總壓強為0.10MPa。B點的化學平衡常數的值是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從鋁土礦(主要成分為Al2O3,還有少量雜質)中提取鋁的工藝流程及步驟如下:
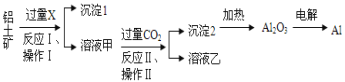
試回答下列問題:
(1)試劑X為__________;
(2)寫出試劑X溶解Al2O3的化學方程式________
(3)操作Ⅰ、操作Ⅱ均為_________(填操作名稱);
(4)金屬鋁與氧化鐵混合在高溫下,會發生劇烈的反應,該反應的化學方程式為_______;
(5)反應Ⅱ的離子方程式為______;
(6)電解熔融氧化鋁制取金屬鋁,若有0.6 mol電子發生轉移,理論上能得到金屬鋁的質量是________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 是一種重要的化工原料,下列有關說法錯誤的是( )
是一種重要的化工原料,下列有關說法錯誤的是( )
A.該物質的分子式為C7H8O
B.該物質屬于芳香族化合物的同分異構體共有4種(不包括其本身)
C.該分子中所有碳原子共平面
D.1 mol該物質與足量的Na反應可產生11.2 L H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備 BaCl2·2H2O有如下兩種途徑。
途徑 1:以重晶石(主要成分BaSO4)為原料,流程如下:
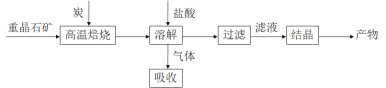
(1)寫出“高溫焙燒”時反應的化學方程式:_____________________________________。
(2)氣體用過量NaOH溶液吸收,得到硫化鈉。Na2S水解的離子方程式為_____________。
(3)向BaCl2溶液中加入AgNO3和KBr,當兩種沉淀共存時,![]() =___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=___________。 [Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
途徑 2:以毒重石(主要成分BaCO3,含Ca2+、Mg2+、Fe3+等雜質)為原料,流程如下:
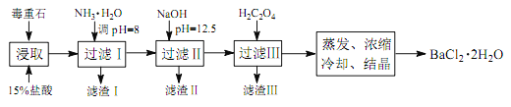
已知:Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
開始沉淀時的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀時的 pH | 13.9 | 11.1 | 3.7 |
(4)為提高礦石的浸取率,可采取的措施是_________。
(5)加入 NH3·H2O 調節 pH=8 可除去___________(填離子符號),濾渣Ⅱ中含_________(填化學式)。加入 H2C2O4時應避免過量,原因是_________。
(6)重量法測定產品純度的步驟為:準確稱取 m g BaCl2·2H2O試樣,加入100 mL水, 用3 mL 2 mol·L-1 的 HCl溶液加熱溶解。邊攪拌,邊逐滴加入0.1 mol·L-1 H2SO4 溶液。待BaSO4完全沉降后,過濾,用0.01 mol·L-1 的稀H2SO4洗滌沉淀 3~4 次,直至洗滌液中不含Cl-為止。將沉淀置于坩堝中經烘干灼燒至恒重,稱量為n g。則BaCl2·2H2O的質量分數為_________。
(7)20℃時,PbCl2(s)在不同濃度鹽酸中的最大溶解量(單位:g·L-1)如圖所示。下列敘述正確的是_______________
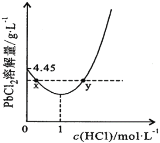
A.鹽酸濃度越大,Ksp(PbCl2)越大
B.PbCl2能與一定濃度的鹽酸反應
C.x、y兩點對應的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入過量濃鹽酸,可將Pb2+完全轉化為PbCl2(s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蛋氨酸銅[Cux(Met)y,Met表示蛋氨酸根離子]是一種新型飼料添加劑。為確定蛋氨酸銅[Cux(Met)y]的組成,進行如下實驗:
(1)稱取一定質量的樣品于錐形瓶中,加入適量的蒸餾水和稀鹽酸,加熱至全部溶解,冷卻后將溶液分成兩等份。
②取其中一份溶液,調節溶液pH在6~8之間。加入0.1000 mol/LI2的標準溶液25.00 mL,充分反應后滴入2~3滴指示劑X,用0.1000 mol/LNa2S2O3標準溶液滴定至藍色恰好褪去,發生反應:![]() 。消耗Na2S2O3標準溶液22.00 mL(蛋氨酸與I2反應時物質的量之比為1:1,產物不與Na2S2O3發生反應)。
。消耗Na2S2O3標準溶液22.00 mL(蛋氨酸與I2反應時物質的量之比為1:1,產物不與Na2S2O3發生反應)。
③向另一份溶液中加入NH3·H2O-NH4Cl緩沖溶液,加熱至70℃左右,滴入2-3滴指示劑PAN,用0.02500 mol/LEDTA (Na2H2Y)標準溶液滴定其中Cu2+(離子方程式為Cu2++H2Y2--=CuY2-+2H+),消耗EDTA標準溶液28.00 mL。
(1)指示劑X為 ____。
(2)用Na2S2O3標準液滴定時,若pH過小,會有S和SO2生成。寫出S2O32-與H+反應的離子方程式 ___________ 。
(3)若滴定管水洗后未用EDTA標準溶液潤洗,測得Cu2+的物質的量將____(填“偏大”、“偏小”或“不變”)。
(4)通過計算確定蛋氨酸銅[Cux(Met)y]的化學式(寫出計算過程)________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com