
分析 (1)氣缸內,氮氣和氧氣在高溫、高壓下反應生成一氧化氮;
(2)結合各種尾氣、廢氣、廢水的主要成分及危害分析;
(3)要提高尾氣處理效果,需要尾氣排放到大氣之前盡可能的轉化為無害氣體,應從速率及平衡的角度分析:
①催化劑,可以加快反應速率,但不影響轉化率;
②提高溫度,能加快反應速率,但會降低轉化率;
③降低壓強,既減慢反應速率,又降低轉化率;
④放入堿石灰,可以吸收生成的二氧化碳,使平衡向右移動;
(4)有毒或有刺激性氣味的物質、固體顆粒物都對環境造成污染;
(5)根據“綠色汽車”的概念來判斷;
(6)天然氣(主要成分CH4)、液化石油氣(C3~C5的烴)其成分均為碳氫化合物.
解答 解:(1)汽車在工作時發動機的活塞在氣缸中運行一個循環時要經過進氣、壓縮、點火燃燒和排氣四個過程,所以又叫四沖程內燃機.在壓縮和點火燃燒等過程中由于產生高壓高溫,空氣中N2和O2發生如下反應:N2+O2$\frac{\underline{\;放電\;}}{\;}$2NO,2NO+O2═2NO2,生成污染大氣的NO、NO2,
故選D;
(2)氮氧化物是形成光化學煙霧的成分,二氧化硫和氮氧化物是形成酸雨的成分,工業廢水是形成公害病的物質,故選A;
(3)①選用適當的催化劑,可以加快反應速率,但不影響轉化率,使有害氣體在排出之前盡可能地轉化為無害氣體,可以提高尾氣處理效果,故正確;
②提高裝置溫度,雖然能加快反應速率,但會降低轉化率,故不正確;
③降低裝置的壓強,既減慢反應速率,又降低轉化率,故不正確;
④裝置中放入堿石灰,可以吸收生成的二氧化碳,使平衡向右移動,提高轉化率,故正確.
故答案為:C;
(4)有毒或有刺激性氣味的物質、固體顆粒物都對環境造成污染,
A.CO2和H2均不屬于有害氣體,故A選;
B.NO2和NO都是有毒氣體,屬于有害氣體,故B不選;
C.CO和SO2都是有毒氣體,屬于有害氣體,故C不選;
D.碳粒和含鉛化合物都是對環境有污染的物質,故D不選;
故選A;
(5)“綠色汽車”是指使用液化石油氣作能源的汽車.綠色汽車可避免有毒的鉛、苯的同系物以及稠環芳烴的排放.燃燒等質量的液化石油氣(主要成分是含C3~C5的烴)與汽油相比較前者產生的含碳化合物少,故選D;
(6)天然氣(主要成分CH4)、液化石油氣(C3~C5的烴)其成分中只含C、H元素,所以均為碳氫化合物,完全燃燒的產物為CO2和H2O,不會造成環境污染,但生成的CO2卻是造成溫室效應的元兇,故選B.
點評 本題考查了生活環境與污染,明確物質的性質是解本題關鍵,運用化學知識解釋生產生活現象,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | FeO與稀硝酸反應:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液與過量NaOH溶液反應:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 溴化亞鐵溶液中通入足量氯氣:2Fe2++4Br-+3Cl2═2Fe3++2 Br2+6Cl- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 PET是聚酯類合成材料,以鹵代烴為原料合成PET的線路如圖(反應中部分無機反應物及產物已省略).已知RX2(R、R′代表烴基,X代表鹵素原子)是芳香族化合物,相對分子質量為175,其中X元素的質量分數為40.6%.
PET是聚酯類合成材料,以鹵代烴為原料合成PET的線路如圖(反應中部分無機反應物及產物已省略).已知RX2(R、R′代表烴基,X代表鹵素原子)是芳香族化合物,相對分子質量為175,其中X元素的質量分數為40.6%. .
. +nHOCH2CH2OH$\stackrel{一定條件下}{→}$
+nHOCH2CH2OH$\stackrel{一定條件下}{→}$ +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
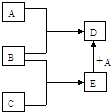 已知A、B、C、D、E均為中學化學中常見物質,在一定條件下相互轉化關系如下圖所示(反應條件和部分產物已省略).已知:
已知A、B、C、D、E均為中學化學中常見物質,在一定條件下相互轉化關系如下圖所示(反應條件和部分產物已省略).已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某溫度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某溫度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③④⑤ | B. | ②③④⑤ | C. | ②⑤⑥⑦ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com