
| 實驗序號 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液體積 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
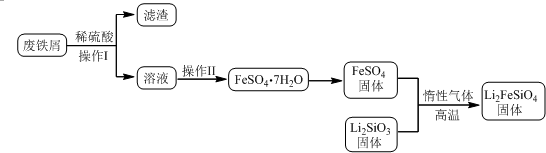
分析 實驗(一)制備流程:廢鐵屑加入稀硫酸過濾得到溶液中通過蒸發濃縮,降溫結晶,過濾洗滌得到FeSO4•7H2O,隔絕空氣加熱分解得到硫酸亞鐵固體,和Li2SiO3反應得到Li2FeSiO4,
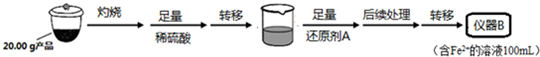
實驗(二) Li2FeSiO4含量測定:取20.00g產品灼燒后加入足量稀硫酸溶解溶液轉移到燒杯中,加入足量還原劑A可用SO2,還原鐵離子為亞鐵離子,
加熱煮沸除去過量的SO2,以免影響后面Fe2+的測定,轉移到儀器B為100ml容量瓶中配制得到準確體積和濃度的溶液,從儀器B中取20.00mL溶液至錐形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4標準溶液裝入儀器C中,用氧化還原滴定法測定Fe2+含量.相關反應為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,雜質不與酸性KMnO4標準溶液反應,測定溶液體積,結合化學方程式定量關系計算,
(1)①操作Ⅱ是溶液中得到硫酸亞鐵晶體的實驗操作,蒸發濃縮,冷卻結晶,過濾洗滌得到;
依據亞鐵離子具有還原性分析;
(2)①實驗二中儀器B為配制溶液需要的容量瓶,儀器C為滴定實驗所用的標準溶液,標準溶液為高錳酸鉀溶液具有氧化性需要盛放在酸式滴定管中;
②還原劑A可用SO2,二氧化硫具有還原性被鐵離子氧化為硫酸,此時后續操作應除去過量的SO2;
③滴定實驗反應終點的判斷是依據高錳酸鉀溶液滴入最后一滴溶液呈淺紅色且半分鐘不變化,依據反應定量關系和實驗數據計算產品中Li2FeSiO4的質量分數,滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失,會造成V(標準)偏大,會造成c(待測)偏高;
解答 解:(1)①操作Ⅱ是溶液中得到硫酸亞鐵晶體的實驗操作,蒸發濃縮,降溫結晶,過濾洗滌得到,
故答案為:蒸發濃縮,降溫結晶,過濾;
②固相法中制備Li2FeSiO4的過程必須在惰性氣體氛圍中進行,因為亞鐵離子具有還原性,易被氧化,所以惰性氣體氛圍中是為了防止亞鐵離子被氧化,
故答案為:防止二價鐵被氧化;
(2)①實驗二中儀器B為配制溶液需要的容量瓶,得到含Fe2+離子的溶液100ml,需要儀器為100ml容量瓶,儀器C中為滴定實驗所用的標準溶液,標準溶液為高錳酸鉀溶液具有氧化性能腐蝕橡膠管,需要盛放在酸式滴定管中,名稱為酸式滴定管,
故答案為:酸式滴定管;
②還原劑A可用SO2,二氧化硫具有還原性被鐵離子氧化為硫酸,反應的離子方程式為:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,此時后續操作應除去過量的SO2以免影響后面Fe2+的測定,
故答案為:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+;除去過量的SO2,以免影響后面Fe2+的測定;
③滴定實驗反應終點的判斷是依據高錳酸鉀溶液滴入最后一滴溶液呈淺紅色且半分鐘不變化,從儀器B中取20.00mL溶液至錐形瓶中,另取0.2000mol•Lˉ1的酸性KMnO4標準溶液裝入儀器C中,用氧化還原滴定法測定Fe2+含量.相關反應為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,雜質不與酸性KMnO4標準溶液反應.消耗高錳酸鉀溶液體積第3次誤差較大舍去,計算平均消耗溶液體積,結合離子反應的定量關系計算,V(標準)=$\frac{20.00+19.98+20.02}{3}$ml=20.00ml,鐵元素守恒計算
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
5Li2FeSiO4~5Fe2+~MnO4-,
5 1
n 0.2000mol/L×0.020L
n=0.0200mol
100ml溶液中含物質的量=0.0200mol×$\frac{100}{20}$=0.1000mol,
產品中Li2FeSiO4的質量分數=$\frac{0.1mol×162g/mol}{20.00g}$×100%=81.00%,
滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失,會造成V(標準)偏大,會造成c(待測)偏高,
故答案為:溶液變為淺紅色,且半分鐘內不變色;81.00%;偏高;
點評 本題考查了物質制備、物質含量測定和滴定實驗過程的分析應用,注意實驗基本操作的理解應用,掌握基礎是解題關鍵,題目難度中等.


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同條件下,平衡時若充入稀有氣體,SO2的轉化率增大 | |
| B. | 0~6 min的平衡反應速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他條件不變,僅降低溫度,正反應速率減小程度比逆反應速率減小程度大 | |
| D. | 反應開始時,向容器中通入的SO2的物質的量是1.4 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
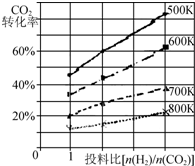 將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3OCH3(g)+3H2O(g);△H
將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3OCH3(g)+3H2O(g);△H查看答案和解析>>
科目:高中化學 來源: 題型:解答題
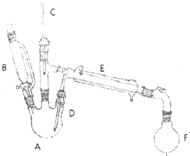 溴乙烷是有機合成的重要原料,實驗室合成溴乙烷的裝置示意圖、相關原理和數據如下:
溴乙烷是有機合成的重要原料,實驗室合成溴乙烷的裝置示意圖、相關原理和數據如下:| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 難溶 |
| 濃硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 天然植物油常溫下一般呈液態,難溶于水,沒有恒定的熔點、沸點 | |
| B. | 乙醛、乙酸和葡萄糖都能與新制的Cu(OH)2反應,且反應類型均為氧化反應 | |
| C. | 乙醛、氯乙烯和乙二醇均可作為合成聚合物的單體 | |
| D. | 石油催化裂化的主要目的是提高汽油等輕質油的產量與質量;石油裂解的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com