
 化合物AX3和單質X2在一定條件下反應可生成化合物AX5,該反應不能徹底.回答下列問題:
化合物AX3和單質X2在一定條件下反應可生成化合物AX5,該反應不能徹底.回答下列問題:分析 (1)根據熔沸點判斷出常溫下各物質聚集狀態,注明聚集狀態與反應熱書寫熱化學方程式;
(2)①用α表示AX3的平衡轉化率,則參加反應AX3為0.2α mol,則:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
轉化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同溫度體積下,壓強之比等于其物質的量之比,據此列方程計算α的表達式;
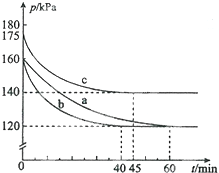
由圖可知,實驗c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,代入α的表達式計算;
若在實驗a中再加入0.1mol AX5,等效為增大壓強,等效后平衡向正反應方向移動,再次達平衡后AX3的平衡轉化率將增大;
②可逆反應到達平衡時,正逆反應速率相等,各組分的含量、濃度保持不變,由此衍生其它一些物理量不變,注意選擇判斷平衡的物理量應隨反應進行發生變化,當該物理量由變化到不變化,說明到達平衡;
③由圖可知,實驗a在60min時到達平衡,平衡時AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,則參加反應AX3的物質的量為0.2mol×50%=0.1mol,根據方程式可知生成AX5的物質的量,再根據v=$\frac{△c}{△t}$計算v(AX5;
④由于恒溫恒容下,壓強之比等于氣體物質的量之比,故相同時間內壓強變化量越大,反應速率越快;
實驗a、b相比,起始壓強相等,平衡時壓強不變,改變條件不影響平衡移動,但b到達平衡的時間較短,反應速率較快,由于反應前后氣體的體積減小,b應是使用催化劑;
a、c相比c組的反應速率加快,平衡時c的壓強變化相對較小,說明與a相比,平衡逆向移動,說明是溫度升高;
正反應為放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小,而c組的溫度高于a組;
c組平衡時,AX3的平衡轉化率αc為40%,平衡常數K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol,代入數據計算.
解答 解:(1)因為AX3的熔點和沸點分別為-93.6℃和76℃,AX5的熔點為167℃,則室溫時,AX3為液態,AX5為固態,生成1mol AX5,放出熱量123.8kJ,該反應的熱化學方程為:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案為:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1;
(2)用α表示AX3的平衡轉化率,則參加反應AX3為0.2α mol,則:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
轉化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同溫度體積下,壓強之比等于其物質的量之比,故0.4:[0.2(1-α)+0.2(1-α)+0.2α]=P0:P,整理得:α=2(1-$\frac{p}{{p}_{0}}$),
由圖可知,實驗c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,則 AX3的平衡轉化率αc為2×(1-$\frac{140}{175}$)=40%,
若在實驗a中再加入0.1mol AX5,等效為增大壓強,等效后平衡向正反應方向移動,再次達平衡后AX3的平衡轉化率將增大,
故答案為:α=2(1-$\frac{p}{{p}_{0}}$);40%;增大;
②A.混合氣體總質量不變,隨反應進行總物質的量增大,平均相對分子質量減小,混合氣體的平均相對分子質量保持不變,說明反應到達平衡,故A正確;
B.混合氣體總質量不變,容器體積不變,混合氣體密度始終保持不變,不能說明到達平衡,故B錯誤;
C.X2的體積分數保持不變,說明到達平衡,故C正確;
D.每消耗1mol AX3的同時消耗1mol AX5,則消耗1mol AX5的同時生成1molAX3,AX3的生成速率與消耗速率相等,反應到達平衡,故D正確,
故選:B;
③由圖可知,實驗a在60min時到達平衡,平衡時AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,則參加反應AX3的物質的量為0.2mol×50%=0.1mol,由方程式可知生成AX5的物質的量為0.1mol,故v(AX5)=$\frac{\frac{0.1mol}{10L}}{60min}$=0.00017mol/(L•min ),
故答案為:0.00017;
④由于恒溫恒容下,壓強之比等于氣體物質的量之比,故相同時間內壓強變化量越大,反應速率越快,由圖可知,從開始到平衡時a、b、c壓強分別為40kPa、40kPa、35kPa,所用時間分別為60min、40min、45min,每分鐘內壓強平均變化分別為$\frac{40}{60}$Pa、$\frac{40}{40}$Pa、$\frac{35}{45}$Pa,故反應速率b>c>a;
實驗a、b相比,起始壓強相等,平衡時壓強不變,改變條件不影響平衡移動,但b到達平衡的時間較短,反應速率較快,由于反應氣體氣體的體積減小,b應是使用催化劑;
a、c相比c組的反應速率加快,平衡時c的壓強變化相對較小,說明與a相比,平衡逆向移動,說明是溫度升高;
正反應為放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小,而c組的溫度高于a組,故平衡常數Ka>Kc;
c組平衡時,AX3的平衡轉化率αc為40%,平衡常數K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol=($\frac{0.2×0.4}{0.2(1-0.4)×0.2×(1-0.4)}$×10)L/mol=55.6L/mol,
故答案為:b>c>a;加入催化劑;升高溫度;>;55.6L/mol.
點評 本題考查化學平衡計算,過程復雜且為字母型計算,屬于易錯題目,是對學生綜合能力的考查,需要學生具備扎實的基礎,題目難度較大.


 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:解答題
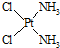 )中的Pt的化合價為+2.
)中的Pt的化合價為+2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 3種 | C. | 4種 | D. | 5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH;G的同分異構體有多種,則滿足下列條件的共有12種.
+(2n-1)CH3OH;G的同分異構體有多種,則滿足下列條件的共有12種. 合成
合成 的流程圖(寫出反應物和反應條件).注:書寫格式參照如下示例流程圖:
的流程圖(寫出反應物和反應條件).注:書寫格式參照如下示例流程圖:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
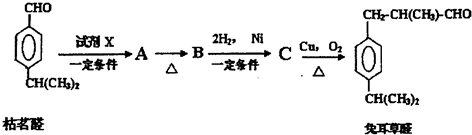
 ;檢驗B中的官能團時,需先加入的試劑是新制氫氧化銅懸濁液;酸化后,再加入的試劑是溴水或高錳酸鉀溶液.
;檢驗B中的官能團時,需先加入的試劑是新制氫氧化銅懸濁液;酸化后,再加入的試劑是溴水或高錳酸鉀溶液. .
.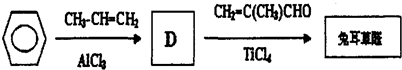
 .D→兔耳草醛的反應類型是加成反應.
.D→兔耳草醛的反應類型是加成反應. 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
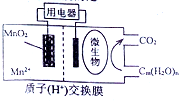 如圖為一種微生物燃料電池結構示意圖,關于該電池敘述正確的是( )
如圖為一種微生物燃料電池結構示意圖,關于該電池敘述正確的是( )| A. | 分子組成為Cm(H2O)n的物質一定是糖類 | |
| B. | 正極反應式為:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放電過程中,H+從正極區移向負極區 | |
| D. | 若Cm(H2O)n是葡萄糖,當電路中轉移了6NA電子時,反應的葡萄糖質量是60g. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
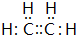 ,A的結構簡式H2C=CH2.
,A的結構簡式H2C=CH2. ,寫出B的一種含三鍵且無支鏈的鏈烴的結構簡式CH≡C-CH=CH-CH=CH2.
,寫出B的一種含三鍵且無支鏈的鏈烴的結構簡式CH≡C-CH=CH-CH=CH2.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
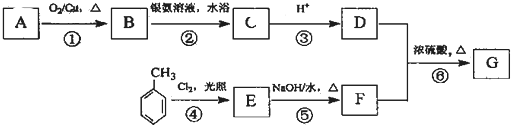
 ;
; .
.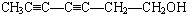 或
或 或
或 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com