23.0g金屬鈉投入到足量的重水中,則產生的氣體中含有( )
A.0.5mol中子
B.1.0NA電子
C.0.5mol質子
D.0.5NA原子
【答案】
分析:根據金屬鈉和水的反應寫出金屬鈉和重水的反應,然后根據方程式進行計算.
解答:解:金屬鈉和重水的反應方程式為:2Na+2D
2O=2NaOD+D
2↑,設23.0g金屬鈉投入到足量的重水中,生成D
2的物質的量是n,則
2Na+2D
2O=2NaOD+D
2↑
2 1
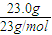
n
則
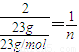
解得n=0.5mol,所以則產生的氣體中含有電子的物質的量為:0.5mol×2=1.0mol,即1.0N
A電子,故B正確,一個D
2中含有兩個氘原子,一個氘原子含有的質子數是1,中子數是1,質量數是2,所以0.5molD
2的中子為0.5mol×2=1.0mol,故A錯誤,0.5molD
2的質子為0.5mol×2=1.0mol,故C錯誤,0.5molD
2的原子數為0.5mol×2=1.0mol,即0.5N
A個原子,故D錯誤.
故選B.
點評:本題要求學生具有一定的知識遷移能力,可以根據所學知識來回答,難度不大.

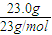 n
n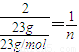


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案