
| 實驗步驟(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
| 取少量完全分解的固體產物于試管中,加入稀鹽酸 | 若有淡黃色沉淀,則有Na2S2O3存在 |
分析 II.根據電子得失守恒和原子守恒書寫化學方程式;連二亞硫酸鈉是一種白色粉末,易溶于水,難溶于乙醇;
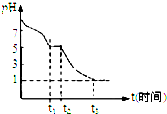
III.(1)Na2S2O4溶液在空氣中易被氧化生成亞硫酸氫鈉,t3時溶液的pH=1,說明溶液的酸性較強,因此亞硫酸氫鈉被氧化為硫酸氫鈉;(2)隔絕空氣加熱Na2S2O4固體完全分解,得到固體產物Na2SO3、Na2S2O3和氣體,其中亞硫酸鈉是氧化產物,而Na2S2O3中S是+2價,則根據氧化還原反應中電子得失守恒可知氣體應該是SO2.根據反應Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要檢驗硫代硫酸鈉;
(3)保險粉與過量的H2O2在水溶液中反應生成硫酸鹽,結合質量守恒和電荷守恒書寫.
解答 解:II.反應中S元素的化合價從+4價降低到+3價,得到1個電子.甲酸鈉中碳元素的化合價從+2價升高到+4價,則根據電子得失守恒和原子守恒可知反應的化學方程式為2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.連二亞硫酸鈉是一種白色粉末,易溶于水,難溶于乙醇,因此可以用乙醇洗滌產品,
故答案為:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O; 乙醇;
III.(1)Na2S2O4溶液在空氣中易被氧化生成亞硫酸氫鈉,則0~t1段發生離子反應方程式為 2S2O42-+O2+2H2O=4HSO3-.t3時溶液的pH=1,說明溶液的酸性較強,因此亞硫酸氫鈉被氧化為硫酸氫鈉,則溶液中主要陰離子符號是SO42-,故答案為:2S2O42-+O2+2H2O=4HSO3-;SO42-;
(2)隔絕空氣加熱Na2S2O4固體完全分解,得到固體產物Na2SO3、Na2S2O3和氣體,其中亞硫酸鈉是氧化產物,而Na2S2O3中S是+2價,則根據氧化還原反應中電子得失守恒可知氣體應該是SO2.根據反應Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O可知要檢驗硫代硫酸鈉,則只需要取少量完全分解的固體產物于試管中,加入稀鹽酸,如果有淡黃色沉淀,則有Na2S2O3存在,故答案為:SO2;
| 實驗步驟(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
| 取少量完全分解的固體產物于試管中,加入稀鹽酸 | 若有淡黃色沉淀,則有Na2S2O3存在 |
點評 本題考查氧化還原反應、水解反應、物質制備和檢驗實驗設計與探究,涉及對反應原理、裝置及操作的分析評價、離子方程式的書寫等,注意對物質性質信息的應用,難度中等.


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案科目:高中化學 來源: 題型:選擇題
| A. | NaOH、蔗糖、NH3•H2O | B. | NH4Cl、HClO、Na2S | ||
| C. | CH3COONa、HCl、BaSO4 | D. | NaCl、SO2、Ba(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L水中所含的分子數約為6.02×1023個 | |
| B. | 1 mol Cl2參加反應轉移電子數一定為2 NA個 | |
| C. | 48gO3與O2的混合氣體中含有的氧原子數為3NA 個 | |
| D. | 從1L0.5 mol/LNaCl溶液中取出100mL,剩余溶液中NaCl物質的量濃度為0.45mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性小組探究乙酸乙酯的反應機理,實驗如下:
某研究性小組探究乙酸乙酯的反應機理,實驗如下:| 密度g/mL | 熔點/℃ | 沸點/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |


 后脫水,失水有兩種可能分別生成
后脫水,失水有兩種可能分別生成 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 指示劑 | a | b | c |
| 變色pH范圍 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 說明 | pH<3.1顯紅色 pH>4.4顯黃色 | pH<8.0顯無色 pH>10.0顯紅色 | pH<4.4顯紅色 pH>6.2顯黃色 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有不法商販才使用食品添加劑 | |
| B. | 凡是食品添加劑均對人體有害 | |
| C. | 在限量范圍內使用食品添加劑不會對人體造成危害 | |
| D. | 味精是食品添加劑,而碘鹽中的“碘”不是添加劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 偏高 | B. | 偏低 | C. | 準確 | D. | 無法判斷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com