
【題目】A (乙炔)是基本有機化工原料。由A制備高分子可降解塑料(PVB)和IR的合成路線(部分反應條件略去)如圖所示。

回答下列問題:
(1)實驗室制備A的化學反應方程式為 ____________________________________。
(2)過程①的反應類型為____________。B中含氧官能團的名稱是____________________。
(3)反應③的化學方程式為_____________________________________。反應⑧的化學方程式為_____________________________________。
(4)關于過程②,下列說法正確的是_____(填序號)。
a.反應②屬于縮聚反應 b.該高分子材料可用于生產吸汗織物
c.該高分子鏈節具有和其單體一樣的結構 d.生成的高分子化合物具有熱塑性,且為混合物
e.通過質譜儀測得該高分子的平均相對分子質量為30444,可推知其n約為354
(5)D和IR的結構簡式分別是_____________________、__________________。
(6)與過程⑦的產物含相同官能團的同分異構體有____種。(己知碳碳雙鍵與羥基直接相連不穩定)
(7)已知: ,(R、R'表示烴基或氫);以A為起始原料,選用必要的無機試劑合成D,寫出合成路線_____________________(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
,(R、R'表示烴基或氫);以A為起始原料,選用必要的無機試劑合成D,寫出合成路線_____________________(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)。
【答案】 CaC2+2H2O→Ca(OH)2+C2H2 加成反應 酯基 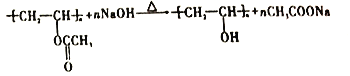
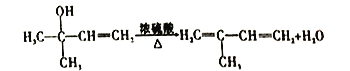 de CH3CH2CH2CHO
de CH3CH2CH2CHO 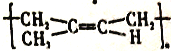 16
16 ![]()
【解析】由分子式可知A為HC≡CH,與乙酸發生加成反應生成B為CH2=CHOOCCH3,發生加聚反應生成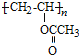 ,水解生成C為
,水解生成C為![]() ,由PVB可知D為CH3CH2CH2CHO;HC≡CH與丙酮在KOH條件下反應生成
,由PVB可知D為CH3CH2CH2CHO;HC≡CH與丙酮在KOH條件下反應生成 ,與氫氣發生加成反應生成
,與氫氣發生加成反應生成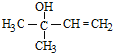 ,發生消去反應生成異戊二烯,異戊二烯在催化作用下發生加聚反應生成順式聚異戊二烯。則
,發生消去反應生成異戊二烯,異戊二烯在催化作用下發生加聚反應生成順式聚異戊二烯。則
(1)實驗室制備乙炔的化學反應方程式為 CaC2+2H2O→Ca(OH)2+C2H2;
由以上分析可知A為乙炔,B為CH2=CHOOCCH3,含有的官能團為碳碳雙鍵和酯基,故答案為:乙炔;碳碳雙鍵和酯基;(2)根據以上分析可知過程①的反應類型為加成反應。B為CH2=CHOOCCH3,其中含氧官能團的名稱是酯基。(3)根據以上分析可知反應③的化學方程式為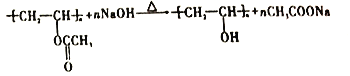 。反應⑧的化學方程式為
。反應⑧的化學方程式為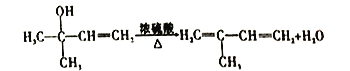 。(4)a.反應②屬于加聚反應,a錯誤;b.分子中含有酯基,沒有親水基團,沒有親水性,該高分子材料不能用于生產吸汗織物,b錯誤;c.該高分子是加聚產物,單體中含有碳碳雙鍵,其鏈節不具有和其單體一樣的結構,c錯誤;d.加聚得到線型高分子,因此生成的高分子化合物具有熱塑性,且為混合物,d正確;e.通過質譜儀測得該高分子的平均相對分子質量為30444,由于B的相對分子質量是86,所以n=30444÷86=354,e正確,答案選de;(5)根據以上分析可知D和IR的結構簡式分別是CH3CH2CH2CHO、
。(4)a.反應②屬于加聚反應,a錯誤;b.分子中含有酯基,沒有親水基團,沒有親水性,該高分子材料不能用于生產吸汗織物,b錯誤;c.該高分子是加聚產物,單體中含有碳碳雙鍵,其鏈節不具有和其單體一樣的結構,c錯誤;d.加聚得到線型高分子,因此生成的高分子化合物具有熱塑性,且為混合物,d正確;e.通過質譜儀測得該高分子的平均相對分子質量為30444,由于B的相對分子質量是86,所以n=30444÷86=354,e正確,答案選de;(5)根據以上分析可知D和IR的結構簡式分別是CH3CH2CH2CHO、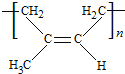 。(6)與過程⑦的產物含相同官能團的同分異構體應該含有碳碳雙鍵和羥基,則可以是C=C-C-C-C,羥基的位置是3種,或者C-C=C-C-C,羥基的位置是3種,且均存在順反異構體,或者是C=C-C(CH3)2,羥基的位置有2種,或者是C=C(CH3)-C-C,羥基的位置有3種,或者是C-C=C(CH3)2,羥基的位置有2種,其中一種存在順反異構體,合金是17種,所以還有16種。(7)根據已知信息并結合逆推法可知以A為起始原料,合成D的合成路線為
。(6)與過程⑦的產物含相同官能團的同分異構體應該含有碳碳雙鍵和羥基,則可以是C=C-C-C-C,羥基的位置是3種,或者C-C=C-C-C,羥基的位置是3種,且均存在順反異構體,或者是C=C-C(CH3)2,羥基的位置有2種,或者是C=C(CH3)-C-C,羥基的位置有3種,或者是C-C=C(CH3)2,羥基的位置有2種,其中一種存在順反異構體,合金是17種,所以還有16種。(7)根據已知信息并結合逆推法可知以A為起始原料,合成D的合成路線為![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】在生物體內含量極少,但對于維持生物體的正常生命活動必不可少的元素有( )
A. Zn、Cu、B. Mn B. Zn、Cu、Mg、Ca
C. Fe、Mn、Zn、Mg D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關。下列說法不正確的是
A. 冬天用的暖貼是利用鐵的吸氧腐蝕原理放熱
B. Na2S2O5可用作葡萄酒的添加劑
C. 食鹽可用作食品調味劑和防腐劑
D. 制造普通玻璃的原料是石灰石、黏土和石英
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有體積相同的兩份營養液,其配方如下:
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
第一份 | 0.3 mol | 0.2 mol | 0.1 mol | —— |
第二份 | 0.1 mol | 0.3 mol | —— | 0.1 mol |
兩份營養液中各離子濃度
A.完全不同 B.完全相同 C.僅c(K+)相同 D.僅c(Cl)相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組探究在加熱條件下FeSO4分解的氣體產物及相關性質。已知:SO2的沸點為-10℃、SO3的沸點為44.8℃。
Ⅰ.用如圖所示裝置設計實驗,驗證分解FeSO4生成的氣態產物。

(1)實驗前必須進行的操作是_______________________。
(2)按氣流方向連接各儀器,用字母表示接口的連接順序:a→_________________。
(3)若觀察到裝置丙中有無色液體產生,裝置丁中溶液變成無色,則 FeSO4分解的化學方程式為____________________。
Ⅱ.為探究SO2使品紅溶液褪色的原理,進行如下實驗:
實驗1:將稀鹽酸和NaOH溶液分別滴入品紅水溶液中。觀察到前者溶液顏色變淺,但未能完全褪色,后者溶液顏色幾乎不變。
實驗2:在滴有稀鹽酸和NaOH溶液的兩份品紅水溶液中分別通入SO2。觀察到前者溶液逐漸褪色,后者溶液很快褪色。
實驗3:在兩份品紅水溶液中分別加入一小粒Na2SO3固體和NaHSO3固體,前者溶液很快褪色,后者溶液褪色很慢。
(1)由實驗1可推測品紅水溶液呈________性。
(2)由實驗2、3可推知,使品紅水溶液褪色的主要微粒是_________(填化學式)。
(3)若將SO2通入品紅的無水乙醇溶液,試預測可能出現的現象________________。
(4)加熱溶有Na2SO3的品紅水溶液,發現不能恢復紅色,試解釋原因____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應mX(g)+nY(g)═qZ(g)的△H<0,m+n>q,在恒容密閉容器中反應達到平衡時,下列說法正確的是
A.通入稀有氣體使壓強增大,平衡將正向移動
B.X的正反應速率是Y的逆反應速率的![]() 倍
倍
C.降低溫度,混合氣體的平均相對分子質量變小
D.增加X的物質的量,Y的轉化率降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把18.0 mol·L1的濃硫酸稀釋成2.00 mol·L1的稀硫酸100 mL,實驗操作如下:
A.將配好的稀硫酸倒入試劑瓶中,貼好標簽;
B.蓋好容量瓶塞,反復顛倒,搖勻;
C.用量筒量取_______mL的18.0 mol·L1的濃硫酸;
D.將______________沿燒杯內壁慢慢注入盛有少量______________的燒杯中;
E.用少量蒸餾水洗滌燒杯和玻璃棒2~3次,并將洗滌液也全部轉移到容量瓶中;
F.將已冷卻至室溫的硫酸溶液沿玻璃棒注入_______mL的容量瓶中;
G.改用膠頭滴管逐滴加蒸餾水,使溶液凹面恰好與刻度相切;
H.繼續向容量瓶中加蒸餾水,直到液面接近刻度線1~2 cm處。
(1)填寫上述步驟中的空白:
C:____________;D :將____________注入_____________;F:____________。
(2)將上面操作步驟按正確的進行排序______________(用字母表示)。
(3)試分析下列操作會使所配溶液的濃度偏高的是_______(填序號)。
①量取濃硫酸時俯視讀數;
②轉移溶液前,容量瓶中含有少量蒸餾水;
③溶解硫酸用的燒杯、玻璃棒未洗滌;
④未冷卻至室溫定容;
⑤定容時俯視容量瓶的刻度線;
⑥定容后搖勻,發現液面低于刻度線,再滴加蒸餾水至刻度線。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《本草綱目》中收載“燒酒”篇:“自元時始創其法,用濃酒和糟入甑,蒸令氣上……其清如水,味極濃烈,蓋酒露也。”《本草經集注》中記載有關于鑒別消石(KNO3)和樸消(Na2SO4)之法:以火燒之,紫青煙起,云是真消石也”。文字中兩處渉及到“法”。分別是
A. 蒸餾 焰色反應 B. 萃取 升華
C. 蒸餾 丁達爾效應 D. 升華 焰色反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com