
| A. | 離子化合物中一定不含共價鍵,共價化合物中一定不含離子鍵 | |
| B. | 分子間作用力越大,分子的熱穩定性就越大 | |
| C. | 可能存在不含任何化學鍵的晶體 | |
| D. | 酸性氧化物形成的晶體一定分子晶體 |
分析 A.離子化合物中一定含有離子鍵,可能含有共價鍵;
B.分子的穩定性與共價鍵強弱有關;
C.單原子分子中不含共價鍵;
D.二氧化硅為酸性氧化物,其晶體屬于原子晶體.
解答 解:A.離子化合物中一定含有離子鍵,可能含有共價鍵,如NaOH屬于離子化合物含有離子鍵和共價鍵,故A錯誤;
B.分子的穩定性與共價鍵強弱有關,共價鍵越強,分子越穩定,與分子間作用力無關,故B錯誤;
C.單原子分子中不含共價鍵,如稀有氣體分子中沒有共價鍵,其晶體為分子晶體,晶體中只有分子間作用力,故C正確;
D.二氧化硅為酸性氧化物,其晶體屬于原子晶體,所以酸性氧化物形成的晶體不一定分子晶體,故D錯誤.
故選C.
點評 本題考查化合物和化學鍵的關系,明確共價化合物和離子化合物的概念是解本題關鍵,注意二者的區別,難度不大.


 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:解答題
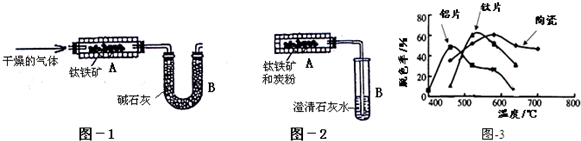
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
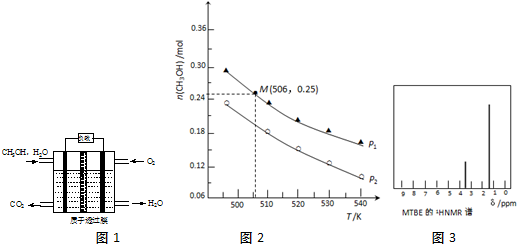
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
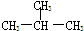
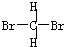 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.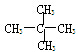 和C(CH)3
和C(CH)3 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若生成NA個水蒸氣分子反應熱為△H0,則△H0<△H | |
| B. | 當有20NA個電子轉移時,放出2600kJ 熱量 | |
| C. | 當有4NA個碳氧共用電子對生成時,放出1300kJ熱量 | |
| D. | 上述反應為吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
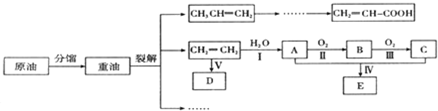
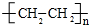 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 濃度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
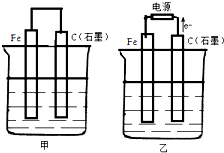 如圖甲、乙是電化學實驗裝置.
如圖甲、乙是電化學實驗裝置.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com