
用乙炔為原料制取CH2Br—CHBrCl,可行的反應途徑是( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2017屆河北省高三上學期摸底考試化學試卷(解析版) 題型:填空題
碘及其化合物在生產、生活和科技等方面都有著重要的應用。回答下列問題:
(1)碘不宜溶于水,但易溶于碘化鉀溶液并生成多碘離子,反應如下:
①I2(s)+I-(aq) I3-(aq) △H<0;②I2(s)+2I-(aq)
I3-(aq) △H<0;②I2(s)+2I-(aq) I42-(aq)。反應②的平衡常數的表達式為K=___________。溫度升高時,反應①的平衡常數將____________(填“增大”“減小”或“不變”)
I42-(aq)。反應②的平衡常數的表達式為K=___________。溫度升高時,反應①的平衡常數將____________(填“增大”“減小”或“不變”)
(2)碘與鎢在一定溫度下,可發生如下可逆反應:W(s)+I2(g) WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
WI2(g)。現準確稱取0.508g碘和0.736g金屬鎢放置于50.0mL的密閉容器中,并加熱使其反應。如圖是混合氣體中的WI2蒸氣的物質的量隨時間變化關系的圖象[n(WI2)~t],其中曲線Ⅰ(0~t2時間段)的反應溫度為450℃,曲線Ⅱ(從t2時刻開始)的反應溫度為530℃。
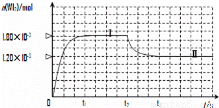
①該反應△H__________0(填“>”或“<”)。
②反應從開始到t1(t1= 3 min)時間內的平均速率v(I2)= 。
③在450℃時,該反應的平衡常數K=______________。
④能夠說明上述反應已經達到平衡狀態的有 (填選項字母)。
A.I2與WI2的濃度相等
B.單位時間內,金屬鎢消耗的物質的量與單質碘生成的物質的量相等
C.容器內混合氣體的密度不再改變
D.容器內氣體壓強不發生變化
(3)I2O5是白色粉末狀固體,可用作氧化劑使H2S、CO、HC1等氧化,在合成氨工業中常用I2O5來定量測量CO的含量。已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1 。寫出CO(g)與I2O5(s)反應析出固態I2的熱化學方程式:__________________________。
查看答案和解析>>
科目:高中化學 來源:2017屆河北省滄州市高三上周測化學試卷(解析版) 題型:選擇題
已知溶液中:還原性HSO3―>I―,氧化性IO3―>I2>>SO32―。向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物質的量的關系曲線如下圖所示,下列說法正確的是

A.a點反應的還原劑是NaHSO3,被氧化的元素是碘元素
B.b點反應的離子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c點到d點的反應中共轉移0.6mol電子
D.往200ml 1mol/LKIO3溶液中滴加NaHSO3溶液,反應開始時的離子方程式是:
5HSO3-+2IO3-=I2+5SO42-+3H++H2O
查看答案和解析>>
科目:高中化學 來源:2017屆河北省滄州市高三上周測化學試卷(解析版) 題型:選擇題
下列化學反應的離子方程式表示正確的是
A.向Na2SiO3溶液中通入過量CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32-
B.向Ca(HCO3)2溶液中滴加少量Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH一=CaCO3↓+BaCO3↓+2H2O
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:H++SO42―+Ba2++OH―=BaSO4↓++H2O
D.Fe(OH)2沉淀中滴加稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高二下期末化學試卷(解析版) 題型:推斷題
肉桂酸芐酯是一種重要的定香劑,可以由化合物A(C7H8O)和乙醛為原料來合成,其合成路線如下:
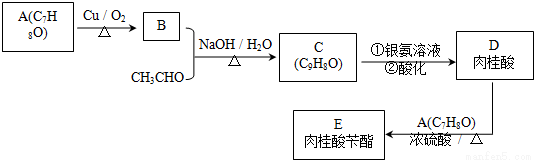
已知:①化合物A苯環上只有一個取代基,且能與鈉反應生成氫氣;
② 。
。
回答以下問題:
(1)B的化學名稱是 ,C中所含的官能團的名稱是 。
(2)寫出D→E的反應類型 ,E的結構簡式是 。
(3)寫出A→B的化學方程式 。
(4)D可以形成一種高分子化合物F,F的結構簡式是 。
(5)D的同分異構體有很多種,其中含有兩個醛基且不能發生水解反應的同分異構體共有___________種。
(6)請按照上述線路,設計一條由CH3CH2OH為原料制備CH3CH2CH2CH2OH的合成線路,有機物用結構簡式表示,無機試劑任選: 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣東省高二下期末化學試卷(解析版) 題型:選擇題
某單官能團有機化合物,只含碳、氫、氧三種元素,相對分子質量為58,完全燃燒時產生等物質的量的CO2和H2O。它可能的結構共有(不考慮立體異構)( )
A.4種 B.5種 C.6種 D.7種
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上開學測化學試卷(解析版) 題型:填空題
下表為元素周期表的一部分。
| 碳 | 氮 | Y |
|
鋁 | X |
| 硫 | Z |
請回答下列問題:
(1)Z元素在周期表中的位置為_______________。
(2)表中元素原子半徑最大的非金屬是(元素符號)_______________。
(3)下列事實能說明Y元素的非金屬性比S元素的非金屬性強的是_______________;
a.Y單質與H2S溶液反應,溶液變渾濁
b.在氧化還原反應中,1 mol Y單質比1 mol S得電子多
c.Y和S兩元素的簡單氫化物受熱分解,前者的分解溫度高
(4)碳與鎂形成的1 mol 化合物Q與水反應,生成2 mol Mg(OH)2和1 mol烴,該烴分子中碳氫質量比為9:1。Q的化學式為_____________________。
(5)向氯化鋁溶液中加入過量氨水,離子方程式為 。
(6)將SO2通入稀硝酸中,反應的離子方程式為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省高二上開學測化學卷(解析版) 題型:推斷題
已知A是石油裂解產生的一種氣態烴,完全燃燒時產生的水和二氧化碳的物質的量之比為1:1。B和D是生活中常見的兩種有機物。它們之間的相互轉化關系如圖所示。(反應條件未寫出)
又知2CH3CHO+O2 2CH3COOH。請回答下列問題;
2CH3COOH。請回答下列問題;
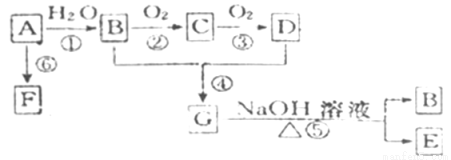
(1)寫出A的電子式 。
(2)B、D分子內含有的官能團分別是 、 (填名稱)。
(3)寫出下列反應的反應類型:② ④ 。
(4)寫出下列反應的化學方程式:
① ;② ;④ ;⑤ 。
(5)燃燒92g的乙醇需要標準狀況下的氧氣體積為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高一上9.4周考化學試卷(解析版) 題型:選擇題
2010年諾貝爾化學獎授予美日科學家,他們由于研究“有機物合成過程中把催化交叉偶聯”而獲獎。鈀的化合物氯化鈀可用來檢測有毒氣體CO,發生反應的化學方程式為:CO+PdCl2+H2O= CO2+Pd↓+2HCl。下列說法正確的是
A.題述反應條件下還原性:CO>Pd
B.題述反應中PdCl2被氧化
C.生成22.4LCO2時,轉移的電子為2mol
D.CO氣體只有在高溫下才能表現還原性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com