
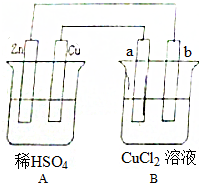
分析 ①A裝置為原電池,Zn比Cu活潑作負極,鋅溶解發生氧化反應,Cu作正極Cu上氫離子得電子生成氫氣發生還原反應;
②B裝置ab都為石墨棒即為電解池,與Cu相連的a為陽極氯離子失電子放出氯氣,與Zn相連的b為陰極銅離子得電子發生還原反應;
③根據分析①②解答;
④根據每一個電極上的得失電子數目相等判斷;
⑤根據溶解的鋅的質量結合轉移電子相等計算.
解答 解:①A裝置為原電池,Zn比Cu活潑作負極,鋅溶解發生氧化反應,Cu作正極Cu上氫離子得電子生成氫氣發生還原反應,所以A燒杯中看到的現象為負極鋅不斷溶解,正極銅表面有氣泡產生,故答案為:負極鋅不斷溶解,正極銅表面有氣泡產生;
②B裝置ab都為石墨棒即為電解池,與Cu相連的a為陽極氯離子失電子放出氯氣,與Zn相連的b為陰極銅離子得電子發生還原反應,所以B燒杯中看到的現象為a棒處有黃綠色的氣體產生,b棒上有紅色的銅析出,故答案為:a棒處有黃綠色的氣體產生,b棒上有紅色的銅析出;
③A裝置為原電池,Zn比Cu活潑作負極,Cu作正極;B裝置ab都為石墨棒即為電解池,與Cu相連的a為陽極,與Zn相連的b為陰極,故答案為:負;正;原電池;陽;陰;電解池;
④因為鋅電極鋅失電子溶解反應式Zn-2e-=Zn2+;Cu上氫離子得電子生成氫氣反應式2H++2e-=H2↑;a為陽極氯離子失電子放出氯氣反應式為2Cl--2e-=C12↑;b為陰極銅離子得電子生成銅反應式為Cu2++2e-=Cu;又每一個電極上的得失電子數目相等,所以Zn棒、Cu棒、a棒、b棒上反應或生成的物質的物質的量之比為1:1:1:1,答:一段時間后Zn棒、Cu棒、a棒、b棒上反應或生成的物質的物質的量之比為1:1:1:1;
⑤A裝置中Zn棒質量減少3.25g,反應式Zn-2e-=Zn2+,即轉移的電子為$\frac{3.25}{65}$×2=0.1mol,又陽極上的電極反應為:2Cl--2e-=Cl2↑,所以消耗的n(Cl-)=0.1mol,則此時B中Cl-的濃度為$\frac{2×0.1×2-0.1}{0.1}$=3mol/L;
答:此時B中Cl-的濃度為3mol/L.
點評 本題考查了原電池原理和電解池原理的應用,明確有關原理及電極反應是解答本題的關鍵,題目難度不大,注重基礎知識的考查.


科目:高中化學 來源: 題型:解答題
 ,CO2
,CO2 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A>B>D>C | B. | B>D>A>C | C. | D>A>B>C | D. | D>B>A>C |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 肼是重要的化工原料.某探究小組利用下列反應制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小組利用下列反應制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂是第IIA族元素 | |
| B. | 第IA族元素全部是金屬元素 | |
| C. | 氧族中含金屬元素 | |
| D. | 第3周期中既有金屬元素又有非金屬元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
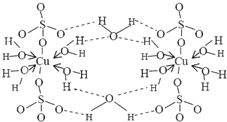 波爾多液是一種保護性殺菌劑,廣泛應用于樹木、果樹和花卉上,鮮藍色的膽礬晶體是配制波爾多液的主要原料.膽礬CuSO4?5H2O可寫成[Cu(H2O)4]SO4?H2O,其結構示意圖如圖:
波爾多液是一種保護性殺菌劑,廣泛應用于樹木、果樹和花卉上,鮮藍色的膽礬晶體是配制波爾多液的主要原料.膽礬CuSO4?5H2O可寫成[Cu(H2O)4]SO4?H2O,其結構示意圖如圖: ,與銅同周期的所有元素的基態原子中最外層電子數與銅原子相同的元素有K、Cr(填元素符號).
,與銅同周期的所有元素的基態原子中最外層電子數與銅原子相同的元素有K、Cr(填元素符號).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com