
分析 A、B、C、D、E五種元素均為短周期元素,原子序數逐漸增大;A是原子半徑最小的元素,則A為H元素;D元素原子的最外層電子數是次外層電子數的3倍,則D含有2個電子層,最外層含有6個電子,為O元素;B可形成多種同素異形體,其中一種的硬度自然界中最大,該物質為金剛石,則B為C元素;E元素的M層電子數等于A和B的質子數之和,則E為Cl元素;C的原子序數介于C元素和O元素之間,則C為N元素,根據分析可知:A、B、C、D、E分別為H、C、N、O、Cl,據此進行解答.
解答 解:A、B、C、D、E五種元素均為短周期元素,原子序數逐漸增大;A是原子半徑最小的元素,則A為H元素;D元素原子的最外層電子數是次外層電子數的3倍,則D含有2個電子層,最外層含有6個電子,為O元素;B可形成多種同素異形體,其中一種的硬度自然界中最大,該物質為金剛石,則B為C元素;E元素的M層電子數等于A和B的質子數之和,則E為Cl元素;C的原子序數介于C元素和O元素之間,則C為N元素,根據分析可知:A、B、C、D、E分別為H、C、N、O、Cl,
(1)D為O元素,原子序數為8,位于周期表中第二周期ⅥA族,
故答案為:第二周期ⅥA族;
(2)非金屬性越強,氣態氫化物越穩定,非金屬性:O>N>C,則對應的氣態氫化物的穩定性為:H2O>NH3>CH4,
故答案為:H2O>NH3>CH4;
(3)10個電子的離子可以以氖為中心,氖前面的陰離子和氖后面的陽離子以及陰離子對應的氫化物、氫化物的陰陽離子等,H、C、N、O形成的10電子粒子有:CH4、NH3(NH2-、NH4+)、H2O(H3O+、OH-)、HF等,以上10電子微粒之間反應的其中一個化學方程式為:NH3+H2O=NH3•H2O或OH-+NH4+=NH3•H2O,
故答案為:NH3+H2O=NH3•H2O或OH-+NH4+=NH3•H2O;
(4)E為Cl元素,ED2為ClO2,C2A4為N2H4,一定條件下4mol ClO2與5mol N2H4恰好完全反應,反應的化學方程式為4ClO2+5N2H4=5N2+4HCl+8H2O,
根據方程式可知,每消耗5molN2H4,轉移電子的物質的量為20mol,所以若反應消耗1mol N2H4,則轉移電子的物質的量為4mol,
故答案為:4ClO2+5N2H4=5N2+4HCl+8H2O;4mol.
點評 本題考查了位置、結構與性質關系的應用,題目難度中等,正確推斷各元素名稱為解答關鍵,注意掌握常見化學用語的概念及表示方法,能夠用單線橋、雙線橋分析氧化還原反應,試題培養了學生靈活應用所學知識解決實際問題的能力.


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
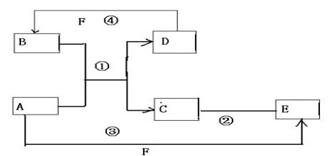
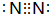 反應?①的化學方程式2NH3+3Cl2=N2+6HCl
反應?①的化學方程式2NH3+3Cl2=N2+6HCl查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14C原子的結構示意圖: | |
| B. | H2O2的電子式: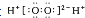 | |
| C. | NH4C的電子式: | |
| D. | 原子核內有10個中子的氧原子${\;}_{8}^{16}$O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
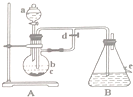 如圖所示裝置,可用來制取和觀察Fe(OH)2在空氣中被氧化的顏色變化.實驗時必須使用鐵屑和6mol/L的硫酸,其他試劑任選.填寫下列空白:
如圖所示裝置,可用來制取和觀察Fe(OH)2在空氣中被氧化的顏色變化.實驗時必須使用鐵屑和6mol/L的硫酸,其他試劑任選.填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:ClO-、Cl-、K+、HSO3- | |
| B. | 無色強酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ | |
| C. | 水電離產生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com