(1)人造空氣(氧氣和氦氣的混合氣體)可供深水潛水員使用.在標準狀況下,5.6L“人造空氣”的質量是2.4g,其中氧氣與氦氣和體積比是______,氧氣的質量為______克.
(2)某密閉容器的質量為50g,當裝滿CO2氣體時,質量為58.8g,如果裝滿CH4氣體,此時密閉容器的總質量為______克.
(3)在某溫度時,一定量的A元素的氣態氫化物AH3在一定體積密閉容器中可完全分解成兩種氣態單質,此時壓強增加了75%.則A單質的一個分子中有______個A原子,AH3分解反應的化學方程式為______.(用A的相關化學式表示,無需推斷A是何種元素)
解:(1)設氧氣的物質的量是x,氦氣的物質的量是y,則
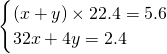
解得
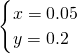
,
相同條件下,氧氣和氦氣的體積之比等于其物質的量之比=0.05mol:0.2mol=1:4,氧氣的質量=0.05mol×32g/mol=1.6g,
故答案為:1:4;1.6;
(2)氣體的物質的量為
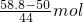
=0.2mol,
則裝滿甲烷時甲烷的質量為0.2mol×16g/mol=3.2g,
即裝滿CH
4氣體時,此密閉容器的質量50g+3.2g=53.2g,
故答案為:53.2;
(3)設分解后生成A
m,則有2mAH
3=2A
m+3mH
2,密閉容器中氣體分子總的物質的量增加了75%,
則有
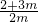
=1+0.75,
m=4,
可得反應的方程式為4AH
3=A
4+6H
2,
故答案為:4;4AH
3=A
4+6H
2.
分析:(1)根據氣體的體積和質量列方程式進行計算;
(2)因容器的體積相同,則氣體的物質的量相等,利用n=

來計算;
(3)設分解后生成A
m,則有2mAH
3=2A
m+3mH
2,根據反應前后物質的量的關系計算.
點評:本題考查物質的量的相關計算,題目難度中等,注意把握相關計算公式的運用,為解答該題的關鍵.

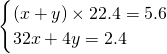 解得
解得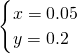 ,
,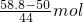 =0.2mol,
=0.2mol,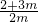 =1+0.75,
=1+0.75, 來計算;
來計算;

 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案