
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔點/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸點/℃ | 136.4 | 1090 | 1412 | 3287 |
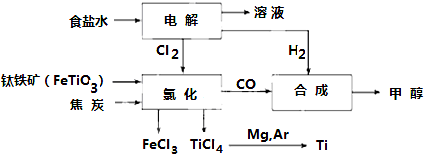
分析 (1)Fe的原子序數為26,根據核外電子排布式確定在周期表中的位置;
(2)鈦鐵礦在高溫下與焦炭經氯化得到四氯化鈦,還生成氯化鐵、CO;
(3)TiCl4水解生成TiO2•xH2O,同時生成HCl;
(4)真空蒸餾的方法分離得到Ti,由表格中數據可知,1412℃Mg、MgCl2為氣態,而Ti沒有熔化;
(5)電解飽和食鹽水,依據電極反應判斷生成產物,書寫離子方程式.
解答 解:(1)Fe的原子序數為26,其最外層電子數為2,有4個電子層,原子核外電子排布為1s22s22p63s23p63d64s2,故處于第四周期第VIII族,
故答案為:第四周期第VIII族;
(2)鈦鐵礦在高溫下與焦炭經氯化得到四氯化鈦,還生成氯化鐵、CO,該反應為2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案為:2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)TiCl4水解生成TiO2•xH2O,同時生成HCl,水解方程式為:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl,
故答案為:TiCl4+(2+x)H2O=TiO2.xH2O↓+4HCl;
(4)真空蒸餾的方法分離得到Ti,由表格中數據可知,1412℃Mg、MgCl2為氣態,而Ti沒有熔化,則選擇溫度略高于1412℃即可蒸餾分離,
故答案為:1412;
(5)電解飽和食鹽水,溶液中的氯離子在陽極失電子生成氯氣,氫離子在陰極得到電子生成氫氣,陰極附近氫氧根離子濃度增大生成氫氧化鈉,反應的離子方程式:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑.
點評 本題以物質的分離提純流程考查化學反應、物質的分離方法及原子結構等,側重學生分析能力及知識遷移應用能力的考查,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
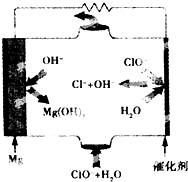 鎂燃料電池具有比能量高、使用安全方便、原材料來源豐富、成本低、燃料易于貯運及污染小等特點.如圖為鎂--次氯酸鹽燃料電池的工作原理圖,下列有關說法不正確的是( )
鎂燃料電池具有比能量高、使用安全方便、原材料來源豐富、成本低、燃料易于貯運及污染小等特點.如圖為鎂--次氯酸鹽燃料電池的工作原理圖,下列有關說法不正確的是( )| A. | 池總反應式為Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正極反應式為ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 該燃料電池中鎂為負極,發生還原反應電 | |
| D. | 放電過程中OH-移向負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用清潔能源是防止酸雨發生的重要措施之一 | |
| B. | CO2、CH4、N2等均是造成溫室效應的氣體 | |
| C. | 節能減排符合低碳經濟的要求 | |
| D. | 合理開發利用可燃冰(固態甲烷水合物)有助于緩解能源緊缺 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①>②>③>④ | B. | ③>①>④>② | C. | ①>③>④>② | D. | ②>③>④>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11.2LCl2通入足量氫氧化鈉溶液中充分反應,轉移的電子數等于0.5NA | |
| B. | 1 mol Al3+完全水解生成氫氧化鋁膠體粒子的數目為NA | |
| C. | 常溫常壓下,32 g O2-中所含電子的數目為17NA | |
| D. | 標準狀況下,11.2 L苯中含有分子的數目為0.5 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A、B、C是中學化學的常見物質,它們在一定條件下有如圖轉化關系:
已知A、B、C是中學化學的常見物質,它們在一定條件下有如圖轉化關系:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 鈉與水的反應:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 銅片跟稀硝酸的反應:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| D. | 金屬鋁溶于氫氧化鈉溶液:Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| TiCl4 | SiCl4 | |
| 熔點/℃ | -25.0 | -68.8 |
| 沸點/℃ | 136.4 | 57.6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com