
合理膳食,保持營養均衡,合理使用藥物是青少年學生健康成長的重要保證。
①維生素C能增強人體對疾病的抵抗能力,促進人體生長發育。在氯化鐵溶液中加入維生素C溶液后,溶液由黃色轉變為淺綠色,說明維生素C具有________性。
②________(填字母)具有止咳平喘作用,可用于治療支氣管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黃堿 b.阿司匹林 c.抗酸藥 d.青霉素
③人們每天攝取的熱能中大約有75%來自糖類,淀粉是一種重要的多糖,它在人體內水解的最終產物是________(填分子式)。碘元素是人體必需的微量元素之一,有“智力元素”之稱,目前,我國通過在食鹽中加入________(填化學式)從而達到補碘的效果。生物制藥中往往涉及到活性蛋白質的提純,可以采用的一種方法是________(填“過濾”、“高溫蒸餾”或“鹽析”)。淀粉、纖維素、油脂、蛋白質中不屬于天然高分子的是____________。
 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源:2016屆天津一中高三零月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是
①質子數相同的粒子一定是同種元素
②同位素的性質幾乎完全相同
③質子數相同,電子數也相同的兩種粒子,不可能是一種分子和一種離子
④電子數相同的粒子不一定是同一種元素
⑤一種元素只能有一種質量數
⑥某種元素的相對原子質量取整數,就是其質量數
A.②③⑤⑥ B.①②④⑤ C.①②⑤⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省雙鴨山市高三上第一次月考化學試卷(解析版) 題型:選擇題
有一塊鎂鋁合金,其中鎂與鋁的質量比是8:9,加入足量稀硫酸使其完全溶解后,再加入NaOH 溶液,生成的沉淀的質量隨NaOH 溶液體積變化的曲線如下圖,其中正確的是
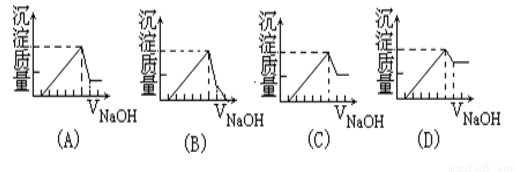
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高一9月檢測化學試卷(解析版) 題型:填空題
(11分)離子反應是中學化學中重要的反應類型,回答下列問題:
(1)在發生離子反應的反應物或生成物中,一定存在有 (填編號)。
①單質 ②氧化物 ③化合物 ④鹽
(2)可用圖示的方法表示不同反應類型之間的關系。如分解反應和氧化還原反應可表示為下圖。請在下面的方框中畫出離子反應、置換反應和氧化還原反應三者之間的關系。
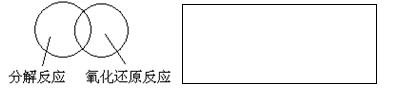
(3)有一瓶澄清的溶液,其中可能含有H+ 、NH4+ 、Mg2+ 、Ba2+ 、Al3+ 、I- 、NO3-、CO32- 、
SO42-、AlO2- ,取該溶液進行以下實驗:
①取pH試紙檢驗,表明溶液呈強酸性。排除_________離子存在。
②取出部分溶液,加入少量CCl 4 及數滴新制氯水,經振蕩后CCl4 呈紫紅色,可以排除_______存在。
③另取部分溶液逐漸加入NaOH溶液,使溶液從酸性逐漸變為堿性,在反應過程中均無沉淀產生,則可排除_________的存在。
④取部分上述堿性溶液加Na 2 CO 3溶液,有白色沉淀生成,證明______存在,又排除________存在。
⑤根據上述實驗事實還不能確定是否存在的離子是____ ____;
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高一9月檢測化學試卷(解析版) 題型:選擇題
下列離子在溶液中因發生氧化還原反應而不能大量共存的是
A.H + 、NO3- 、 Fe 2+ 、Na +
B.Ag + 、 NO3- 、Cl - 、K +
C.K + 、Ba 2+ 、OH - 、SO42-
D.Cu 2+、NH4+ 、Br - 、OH –
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二9月檢測化學試卷(解析版) 題型:填空題
由葡萄糖發酵可得乳酸,為研究乳酸的分子組成和結構,進行了下述實驗:
(1)稱取乳酸0?9 g,在某種狀況下使其完全氣化,相同狀況下同體積的H2的質量為0?02 g,則乳酸的相對分子質量為 g。
(2)若將上述乳酸蒸氣在氧氣中燃燒只生成CO2和H2O?g),當全部被堿石灰吸收時,堿石灰的質量增加1?86 g;若將此產物通入過量石灰水中,則產生3?00 g白色沉淀。則乳酸的分子式為 。
(3)另取0?90 g乳酸,若與足量金屬鈉反應,生成H2 2240 mL(標準狀況),若與足量碳酸氫鈉反應,生成224 mL CO2(標準狀況),則乳酸的結構簡式可能為 或 。
(4)若葡萄糖發酵只生成乳酸,其反應的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二9月檢測化學試卷(解析版) 題型:選擇題
化學與生活密切相關,下列說法正確的是
A.氫氧化鋁、氫氧化鎂可做抗酸藥
B.加碘食鹽中添加的是碘化鉀
C.味覺上具有酸味的食物就是酸性食物
D.凡含有食品添加劑的食物對人體健康均有害
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏回族自治區銀川一中高三上學期第二次月考化學試卷(解析版) 題型:實驗題
[化學——選修化學與技術](15分)電鍍廠鍍銅廢水中含有CN-和Cr2O72-,需要處理達標后才能排放。該廠擬定下列流程進行廢水處理:
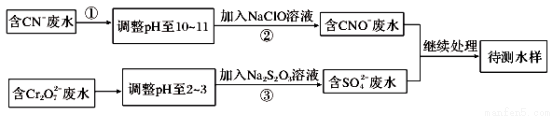
回答下列問題:
(1)上述處理廢水流程中主要使用的方法是____________。
(2)②中反應后無氣體放出,該反應的離子方程式為_______。
(3)步驟③中,每處理0.4 mol Cr2O72-時轉移電子2.4 mol,該反應的離子方程式_________。
(4)取少量待測水樣于試管中,加入NaOH溶液,觀察到有藍色沉淀生成,再加Na2S溶液,藍色沉淀轉化成黑色沉淀,請使用化學用語和文字解釋產生該現象的原因:______________。
(5)目前處理酸性Cr2O72-廢水多采用鐵氧磁體法。該法是向廢水中加入FeSO4·7H2O,將Cr2O72-還原成Cr3+,調節pH,Fe、Cr轉化成相當于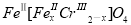 (鐵氧磁體,羅馬數字表示元素價態)的沉淀。處理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列結論正確的是________。
(鐵氧磁體,羅馬數字表示元素價態)的沉淀。處理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列結論正確的是________。
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8 D.x=1.5,a=10
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江大慶鐵人中學高二上9月考化學試卷(解析版) 題型:填空題
(16分)如圖所示裝置,回答下列問題:
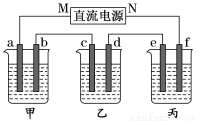
a、b、c、e、f均為石墨電極,甲、乙、丙三個燒杯依次分別盛放足量的NaOH溶液、足量的CuSO4溶液和足量含有酚酞的K2SO4溶液.
(1)通電進行電解,發現丙中f極先變紅色。
①直流電源的M極是 (填“正極”或“負極”)
②請寫出甲池a 電極上的電極反應式:
③甲池電解過程中溶液的pH (填“增大”或“減小”),原因是:
④如果導線中通過4mol電子,則丙中溶液質量 (填“增大”或“減小”) g
(2)若用丙裝置在鐵上鍍銅,需要將丙裝置進行改裝,則e應該是 (填“鐵”或“銅”),電鍍液是 溶液,電鍍過程中電鍍液的濃度 (填“增大”、“減小”或“不變”)。
(3)若用丙裝置對鐵的腐蝕進行防護, (填e或f)為鐵電極,該防護方法稱為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com