
| A. | 平衡向右移動 | B. | x+y>z | C. | B的轉化率提高 | D. | C的體積分數增加 |
分析 保持溫度不變,將容器的體積擴大一倍,如平衡不移動,A的濃度為0.25mol/L,小于實際A的濃度變為0.3mol/L,說明平衡向生成A的方向移動,即向逆反應移動,據此結合選項解答.
解答 解:A、由上述分析可知,平衡向逆反應移動,故A錯誤;
B、增大體積,壓強減小,平衡向逆反應移動,壓強減小平衡向氣體物質的量增大的方向移動,即x+y>z,故B正確;
C、平衡向逆反應方向移動,B的轉化率降低,故C錯誤;
D、平衡向逆反應移動,減小壓強平衡向氣體物質的量增大的方向移動,氣體的物質的量增大,C物質的量減小,故C的體積分數下降,故D錯誤;
故選B.
點評 本題考查化學平衡移動,難度中等,利用假設法判斷平衡移動方向是解題關鍵.


科目:高中化學 來源: 題型:解答題
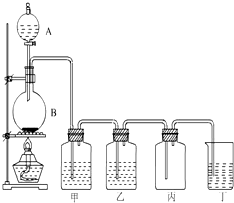 如圖為實驗室制取氯氣的裝置圖,請根據該圖回答下列問題.
如圖為實驗室制取氯氣的裝置圖,請根據該圖回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
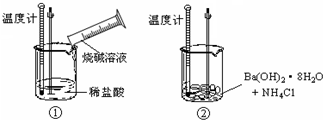
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鋁溶液中加入過量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水與蘇打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亞鐵溶液中通入氯氣:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸鈣溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題

| A. | 配制950ml 2.3mol/LH2SO4溶液需要取該硫酸125.0mL | |
| B. | 1molAl與足量該硫酸反應產生3g氫氣 | |
| C. | 該硫酸在空氣中露置,溶質的質量分數會逐漸減小 | |
| D. | 該硫酸不能用來干燥二氧化硫 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
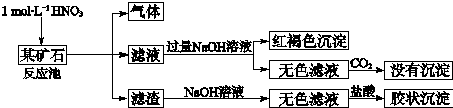
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖所示一套實驗裝置來制取乙酸乙酯,A中盛有乙醇、濃硫酸和醋酸的混合液,C中盛有飽和碳酸鈉溶液.
如圖所示一套實驗裝置來制取乙酸乙酯,A中盛有乙醇、濃硫酸和醋酸的混合液,C中盛有飽和碳酸鈉溶液.| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com