
分析 (1)①NaClO為含氧酸鹽,其余為無氧酸鹽;
②水為純凈物,其余為混合物;
(2)濃H2SO4的物質的量濃度c=$\frac{1000ρw}{M}$,再根據溶液稀釋前后物質的量不變計算所需濃硫酸的體積;根據實驗操作的步驟以及每步操作需要儀器確定反應所需儀器,根據c=$\frac{n}{V}$分析操作對溶質的物質的量或對溶液的體積的影響判斷;
(3)根據Na2CO3+2HCl═2NaCl+H2O+CO2↑來計算原混合溶液中Na2CO3的物質的量濃度.
解答 解:(1)①NaClO為含氧酸鹽,其余為無氧酸鹽,故選:NaClO;
②水為純凈物,其余為混合物,故選:水;
(2)濃H2SO4的物質的量濃度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
根據稀釋定律,稀釋前后溶質的物質的量不變,來計算濃硫酸的體積,設濃硫酸的體積為xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以應量取的濃硫酸體積是13.6mL,用20ml的量筒最好,配制步驟有量取、稀釋、移液、洗滌、定容、搖勻等操作,一般用量筒量取(用到膠頭滴管)稱量,在燒杯中稀釋,冷卻后轉移到500mL容量瓶中,并用玻璃棒引流,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,所以需要的儀器為:玻璃棒、燒杯、膠頭滴管、20mL量筒、500mL容量瓶.
A、濃硫酸溶解后未冷至室溫即進行轉移、定容,一旦冷卻下來會導致體積偏小,濃度偏高,故A正確;
B、定容時仰視刻度線,溶液體積增大,濃度偏低,故B錯誤;
C、量筒是已經測量好的量具,量取溶液體積后不能用水洗滌,量取好濃硫酸倒入燒杯溶解后,用水洗滌量筒2-3次,將洗滌液倒入燒杯 導致溶質量增大,配制濃度偏高,故C正確;
故答案為:13.6;20;500mL容量瓶;AC;
(3)標況下CO2的物質的量為$\frac{0.896L}{22.4L/mol}$=0.04mol,
由Na2CO3+2HCl═2NaCl+H2O+CO2↑可知,酸足量時,
n(Na2CO3)=n(CO2)=0.04mol,
則c(Na2CO3)=$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案為:0.4.
點評 本題考查了一定物質的量濃度溶液的配制,化學方程式的計算,難度中等,根據c=$\frac{n}{V}$理解溶液配制原理與誤差分析,注意濃硫酸的稀釋操作.


 100分闖關期末沖刺系列答案
100分闖關期末沖刺系列答案科目:高中化學 來源: 題型:選擇題
| A. | 22.4LCO和CO2的混合氣體中所含的碳原子數一定是NA | |
| B. | 常溫常壓下,32gO2和32gO3所含氧原子數都是NA | |
| C. | 1molFe與足量鹽酸反應,轉移電子數為3NA | |
| D. | 標準狀況下36g H2O中原子的數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CH3COOC2H5+H2O
CH3COOC2H5+H2O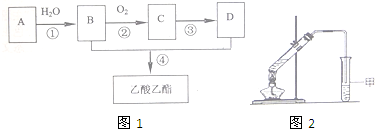
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該電池的工作環境是高溫條件 | |
| B. | 作為負極的葡萄糖(C6H12O6)在變化中失去電子,被還原 | |
| C. | 該電池的電解質溶液是強酸性溶液,如濃硫酸或硝酸等 | |
| D. | 該電池的總反應為C6H12O6+6O2$\frac{\underline{\;催化劑\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 提純膠體可采用滲析的方法 | |
| B. | 用丁達爾效應可以區別溶液和膠體 | |
| C. | 往氯化鐵溶液中滴加少量氫氧化鈉溶液可制得氫氧化鐵膠體 | |
| D. | 加熱可使膠體發生聚沉 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com