

| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
分析 Ⅰ(1)根據化學平衡時正逆反應速率相等,各組分含量保持不變分析選項;
(2)根據圖象達到平衡的時間判斷T1、T2的大小,再由平衡時的狀態判斷平衡移動方向;
(3)根據能量變化圖計算反應熱,反應焓變=反應物的鍵能和-生成物的鍵能和;
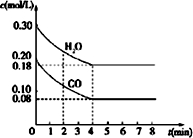
Ⅱ(1)①升高溫度,化學反應速率加快,依此根據10min內,T2時CO轉化率大于T1時判斷溫度的高低;
T2℃下,10min時CO轉化率為35%,20min時CO轉化率為50%,10-20min只轉化15%,說明20min時已達平衡狀態,依此判斷第30min時CO轉化率;列三段式計算K;
②根據濃度商和平衡常數的大小關系,判斷反應進行的方向;
(2)溶液等體積混合溶質濃度減少一半,醋酸電離平衡常數與濃度無關,結合概念計算.
解答 解:Ⅰ(1)恒容密閉容器中發生反應:2NO(g)+O2(g)?2NO2(g),
a.反應是個氣體體積改變的反應,恒容容器,壓強改變,平衡時,體系壓強保持不變,故正確;
b.混合氣體顏色保持不變,說明二氧化氮的濃度保持不變,達到平衡,故正確;
c.NO和O2的起始物質的量相等,但化學計量數不同,變化量就不相同,如果沒有達到平衡,NO和O2 的物質的量之比會發生改變,不發生改變說明到達了平衡,故正確;
d. O2 是反應物,NO2是生成物,不管在任何時候都有每消耗1 molO2同時生成2 molNO2,故錯誤,
故選:abc;
(2)由圖可知先達到平衡所用時間較短的溫度較高,且此溫度下氮氣的體積分數較小,說明溫度升高后,反應正向移動,故反應為吸熱反應;
故答案為:>;
(3)該反應中的反應熱=反應物的鍵能和-生成物的鍵能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,熱化學方程式為:N2(g)+O2(g)=2NO(g)△H=+183 kJ•mol-1;
故答案為:N2(g)+O2(g)=2NO(g)△H=+183 kJ•mol-1;
Ⅱ:(1)①升高溫度,化學反應速率加快,10min內,T2時CO轉化率大于T1時,故T2>T1;
T2℃下,10min時CO2轉化率為35%,20min時CO2轉化率為50%,10-20min只轉化15%,說明20min時已達平衡狀態,故第30min時,CO2轉化率為50%;
T2℃下,CO(g)+2H2(g)═CH3OH(g),
起始(mol) 2 3 0
轉化(mol) 1 2 1
\平衡(mol) 1 1 1
化學平衡常數K=$\frac{1mol÷2L}{(1mol÷2L)(1mol÷2L)^{2}}$=4;
故答案為:>;50%;4;
②拔去鉚釘,容器是在同溫同壓下進行,體積之比等于物質的量之比,當沖入6molCO,假設平衡不移動,此時容器的體積為6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移動,v(正)<v(逆);
故答案為:<;拔去鉚釘,容器是在同溫同壓下進行,體積之比等于物質的量之比,當沖入6molCO,假設平衡不移動,此時容器的體積為6L,Qc=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{36}{7}$>K,故平衡逆向移動,v(正)<v(逆);
(2)反應平衡時,2c(Ba2+)=c(CH3COO-)=bmol/L,據電荷守恒,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸電離平衡常數依據電離方程式寫出K=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}×1{0}^{-7}mol/L$;
故答案為:$\frac{2b}{a-2b}×1{0}^{-7}mol/L$.
點評 本題考查了鍵能與反應熱的關系、化學反應速率影響因素及相關計算、化學平衡的移動原理、平衡常數的相關計算等知識,題目難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
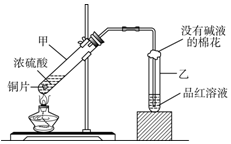 用如圖所示的裝置可以驗證濃硫酸與銅是否發生反應,并探討反應所產生氣體的性質.
用如圖所示的裝置可以驗證濃硫酸與銅是否發生反應,并探討反應所產生氣體的性質.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-總數為0.1NA | |
| B. | 16g16O2和18g18O2中含有的質子數均為8NA | |
| C. | 1molFe與足量的稀硝酸反應,轉移電子數為2NA | |
| D. | 標準狀況下,2.24LCl2溶于水所得溶液中含有的氯離子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)已知在一定溫度下,各反應的平衡常數如下:
(1)已知在一定溫度下,各反應的平衡常數如下:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
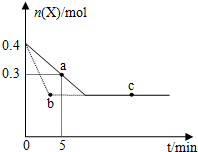
| A. | 虛線表示使用催化劑的情形 | |
| B. | b、c兩點表明反應在相應條件下達到了最大限度 | |
| C. | 反應進行到a點時放出的熱量大于反應進行到b點時放出的熱量 | |
| D. | 反應從開始到a點的平均反應速率可表示為v(Y)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定.請回答:
氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、OH-、Na+、CO32- | B. | Cl-、Na+、Ag+、NO3- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | NH4+、Cl-、Na+、OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com