
| A. | 熱穩定性:HCl>H2S | B. | 原子半徑:N>O | ||
| C. | 結合質子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
分析 A.元素的非金屬性越強,其氫化物的穩定性越強;
B.同一周期元素,原子半徑隨著原子序數增大而減小;
C.元素的非金屬性越強,其簡單陰離子結合氫離子能力越弱;
D.同一種非金屬元素的含氧酸,中心元素化合價越高,其酸性越強.
解答 解:A.元素的非金屬性越強,其氫化物的穩定性越強,非金屬性Cl>S,所以氫化物的穩定性HCl>H2S,故A正確;
B.同一周期元素,原子半徑隨著原子序數增大而減小,所以原子半徑N>O,故B正確;
C.元素的非金屬性越強,其簡單陰離子結合氫離子能力越弱,非金屬性Cl>S,結合質子能力:S2->Cl-,故C正確;
D.同一種非金屬元素的含氧酸,中心元素化合價越高,其酸性越強,所以酸性:H2SO3<H2SO4,故D錯誤;
故選D.
點評 本題考查同一周期元素性質遞變規律,為高頻考點,明確元素非金屬性與其氫化物的穩定性、最高價氧化物的水化物酸性、其簡單陰離子結合質子能力之間的關系是解本題關鍵,易錯選項是D.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
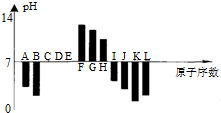
| A. | 元素B對應的氫化物比J對應的氫化物熔沸點更高,原因是B的氫化物中的鍵能比J中的大. | |
| B. | 根據圖形分析可知,K,L兩種元素最高價氧化物對應的水化物的酸性,前者較強. | |
| C. | 晶體IC2熔化時克服的化學鍵和晶體KC2與水反應時克服的化學鍵,類型相同. | |
| D. | 元素K、H、G分別形成的簡單離子的半徑逐漸減少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該混鹽水溶液呈堿性 | |
| B. | 該混鹽與H2SO4反應有氣體生成 | |
| C. | 該混鹽溶液加入BaCl2可以生成白色沉淀 | |
| D. | 該混鹽在酸性條件下可生成S,每產生32g S轉移2NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
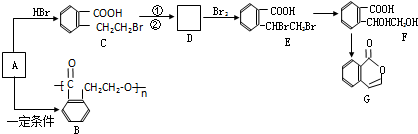
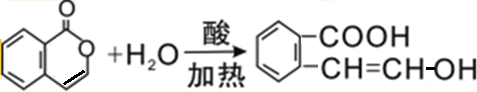
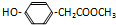 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
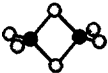 硼的最簡單氫化物--乙硼烷球棍模型如圖,由它制取硼氫化鋰的反應為:2LiH+B2H6=2LiBH4
硼的最簡單氫化物--乙硼烷球棍模型如圖,由它制取硼氫化鋰的反應為:2LiH+B2H6=2LiBH4查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在室溫下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黃色轉變成橙紅色的Na2Cr2O7,溶液中水Kw增大,在此轉化過程中,各物質的量濃度變化如圖所示.下列說法正確的是( )
在室溫下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黃色轉變成橙紅色的Na2Cr2O7,溶液中水Kw增大,在此轉化過程中,各物質的量濃度變化如圖所示.下列說法正確的是( )| A. | 向以上反應加入一定量的Na2CO3溶液,對平衡幾乎沒有影響 | |
| B. | 升高溫度,混合溶液的顏色逐漸加深 | |
| C. | 該反應的離子方程式為:2CrO42-+2H+═Cr2O72-+H2O | |
| D. | 該反應的化學平衡常數為5.0x102 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 濃H2SO4和NaCl晶體 | B. | 甲酸和濃H2SO4(制CO) | ||
| C. | MnO2和濃硫酸 | D. | 濃H3PO4和NaBr晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com