


 ,其中心原子的雜化類型是sp3雜化
,其中心原子的雜化類型是sp3雜化 .
. 分析 (1)N原子核外有7個電子,分兩層排布,根據原子核外電子排布原則:電子優先單獨占據1個軌道,且自旋方向相同是,能量最低;
(2)同一周期,元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第VA族元素大于第VIA族元素,同一主族,元素的第一電離能隨著原子序數的增大而減小;
(3)HN3的構成微粒為分子,疊氮酸為分子晶體;根據等電子體是指具有相同電子數目和原子數目的分子或離子來回答;根據價層電子確定電子式;根據價層電子對互斥理論確定雜化類型,價層電子對個數=σ鍵個數+孤電子對個數來解答;根據n值判斷雜化類型:一般有如下規律:當n=2,sp雜化;n=3,sp2雜化;n=4,sp3雜化;
(4)Cu2+提供空軌道,Cl-提供孤對對子,配位形成CuCl2-離子,該晶胞中Y原子個數=8×$\frac{1}{8}$=1,Ba原子個數=8×$\frac{1}{4}$=2,Cu原子個數=3,O原子個數=10×$\frac{1}{2}$+2=7;
(5)根據物質的相似相溶原理分析.
解答 解:(1)氮元素的原子核外有7個電子,軌道表示式為 ,
,
故答案為: ;
;
(2)同一周期,元素的第一電離能隨著原子序數的增大而呈增大的趨勢,但第VA族元素大于第VIA族元素P>S,同一主族,元素的第一電離能隨著原子序數的增大而減小N>P,所以第一電離能大小順序是:N>P>S,
故答案為:N>P>S;
(3)疊氮酸為非金屬元素組成的共價化合物,屬于分子晶體;CNO-中電子數為:6+7+8+1=22,與CO2具有相同電子數目和原子數目,是等電子體,常見粒子還有N2O等;NH2-價層電子對個數為4,含有2個孤對電子,所以電子式為 ,為sp3雜化;
,為sp3雜化;
故答案為:分子;CO2; ;sp3;
;sp3;
(4)該晶胞中Y原子個數=8×$\frac{1}{8}$=1,Ba原子個數=8×$\frac{1}{4}$=2,Cu原子個數=3,O原子個數=10×$\frac{1}{2}$+2=7,所以該物質的化學式為YBa2Cu3O7,
1mol超導氧化物A晶胞中實際占有的氧原子的物質的量為7mol,
故答案為:7mol;
(5)根據物質的相似相溶原理,極性溶質極易溶于極性溶劑,水是極性溶劑,所以此種化合物是極性溶質,其異構體的結構可用示意圖表示為: ,
,
故答案為: .
.
點評 本題考查內容較為綜合,關于(2)第一電離能變化的趨勢為易錯點,掌握晶胞的計算、正確判斷中心原子的雜化軌道是解本題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
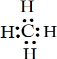
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
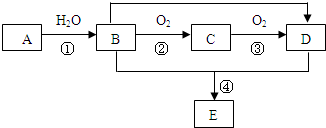
 CH3COOCH2CH3+H2O,反應類型為酯化反應(或取代反應).
CH3COOCH2CH3+H2O,反應類型為酯化反應(或取代反應). ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 酸銅粉末由無色變為藍色,生成的氣體從F頂端逸出,該氣體點燃后可燃燒.
酸銅粉末由無色變為藍色,生成的氣體從F頂端逸出,該氣體點燃后可燃燒.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
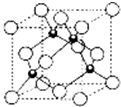 原子序數依次增大的五種元素A、B、C、D、E,其中A是周期表中原子半徑最小元素,B原子基態時最外層電子數是其內層電子數的2倍,D原子基態時2p原子軌道上有2個未成對的電子,E的原子序數為29.
原子序數依次增大的五種元素A、B、C、D、E,其中A是周期表中原子半徑最小元素,B原子基態時最外層電子數是其內層電子數的2倍,D原子基態時2p原子軌道上有2個未成對的電子,E的原子序數為29.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
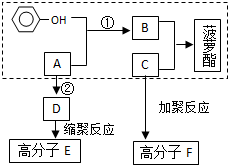 已知方框內是食品香精菠蘿酯的生產路線,A、B又能發生方框外所示的轉化關系.A、B、C的分子式分別C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳雙鍵不能連在同一個碳原子上.
已知方框內是食品香精菠蘿酯的生產路線,A、B又能發生方框外所示的轉化關系.A、B、C的分子式分別C2H3ClO2、C8H8O3、C3H6O.信息:-OH和碳碳雙鍵不能連在同一個碳原子上.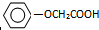 ;E
;E .
. .
.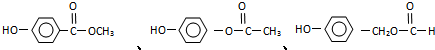 (有幾種填寫幾種).
(有幾種填寫幾種).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com