
| 實驗序號 | a | b | c |
| 合金質量/mg | 510 | 765 | 918 |
| 氣體體積/mL | 560 | 672 | 672 |
分析 (1)先判斷鹽酸是否完全反應,若鹽酸完全反應,根據氫氣求出消耗的鹽酸,再求出濃度;
(2)根據表中數據可知,a組中金屬完全反應,根據金屬的總質量和生成氫氣的物質的量列方程組,計算;
(3)根據方程式中轉化關系以及原子守恒計算.
解答 解:(1)c組實驗中鹽酸完全反應,n(H2)=$\frac{0.672L}{22.4L/mol}$=0.03mol
則c(HCl)=$\frac{2×0.03mol}{0.03L}$=2mol/L.
答:鹽酸的濃度為2mol/L.
(2)設0.510合金中Mg?Al的物質的量分別為x?y,
由于a組實驗中金屬完全反應,生成氫氣n(H2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,
由合金質量知:x×24g/mol+y×27g/mol=0.510g ①
由反應得失電子數相等得:2x+3y=0.025mol×2 ②
解①②得:x=y=0.01 mol
則合金中鎂的質量分數=$\frac{0.01mol×24g/mol}{0.510g}×100%=47.06%$
答:合金中鎂的質量分數為47.06%.
(3)c組實驗合金中n(Al)=n(Mg)=0.01mol×$\frac{0.918g}{0.510g}$=0.018mol
與鹽酸恰好反應后,溶液中只有AlCl3和MgCl2
溶解0.918g合金共需要n(HCl)=0.018 mol×3﹢0.018 mol×2=0.09mol
V(HCl)=$\frac{0.09mol}{2mol/L}=0.045L=45mL$ 答:在c組實驗后,還需向容器中加入15mL同濃度的鹽酸才能使剩余合金恰好完全溶解.
點評 本題考查了合金的有關計算,明確物質之間的反應結合方程式來分析解答,注意根據反應方程式及結合原子守恒進行計算,題目難度較大.


 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:解答題
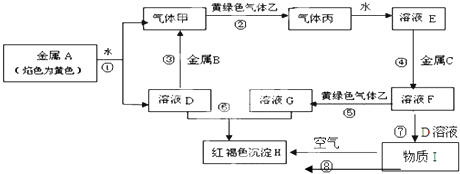
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
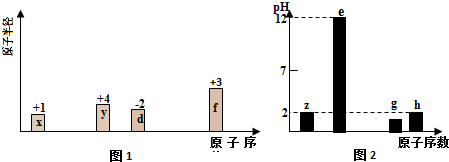
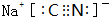 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
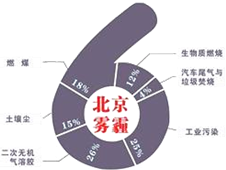 中科院大氣研究所研究員張仁健課題組與同行合作,對北京地區PM2.5有6個重要來源,其中,汽車尾氣和燃煤分別占4%、18%.用于凈化汽車尾氣的反應為2NO(g)+2CO(g)$\stackrel{催化劑}{?}$ 2CO2(g)+N2(g),已知該反應在570K時平衡常數為1×1059,但反應很慢.下列說法正確的是( )
中科院大氣研究所研究員張仁健課題組與同行合作,對北京地區PM2.5有6個重要來源,其中,汽車尾氣和燃煤分別占4%、18%.用于凈化汽車尾氣的反應為2NO(g)+2CO(g)$\stackrel{催化劑}{?}$ 2CO2(g)+N2(g),已知該反應在570K時平衡常數為1×1059,但反應很慢.下列說法正確的是( )| A. | 裝有尾氣凈化裝置的汽車排出的氣體中不再含有NO或CO | |
| B. | 提高尾氣凈化效率的常用方法是升高溫度 | |
| C. | 增大壓強,上述平衡右移,故實際操作中可通過增壓的方式提高其凈化效率 | |
| D. | 提高尾氣凈化效率的最佳途徑是使用高效催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉 | B. | 蔗糖 | C. | 果糖 | D. | 麥芽糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
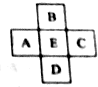 原子序數為x的元素E在周期表中位于A、B、C、D四種元素中間(如圖所示),則A、B、C、D四種元素的原子序數之和不可能是(鑭系、錒系、O族元素除外)( )
原子序數為x的元素E在周期表中位于A、B、C、D四種元素中間(如圖所示),則A、B、C、D四種元素的原子序數之和不可能是(鑭系、錒系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com