
【題目】(1)下列數據是對應物質的熔點(℃)
NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
據此作出的下列判斷中,錯誤的是_____。
A 鋁的化合物晶體中不存在離子晶體
B 表中只有BCl3、干冰是分子晶體
C 同族元素的氧化物可形成不同類型的晶體
D 不同族元素的氧化物可形成不同類型的晶體
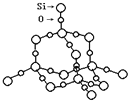
(2)SiO2晶體結構片斷如圖所示。SiO2晶體中Si原子數目和Si﹣O鍵數目的比例為_____。
通常人們把拆開1mol 某化學鍵所吸收的能量看成該化學鍵的鍵能。
化學鍵 | Si-O | Si-Si | O=O |
鍵能/KJmol-1 | 460 | 176 | 498 |
Si(s)+ O2(g)=SiO2(s),該反應的反應熱△H=__________。
(3)單質鋁晶體晶胞特征如圖乙所示.則晶胞中鋁原子的配位數為_____,晶胞中存在兩種空隙,分別是___________、___________。

【答案】AB 1:4 -990 kJ/mol 12 正四面體空隙 正八面體空隙
【解析】
(1)A.由表中數據可知,AlF3、Al2O3為離子晶體,故A錯誤;
B.表中AlCl3、BCl3和干冰是分子晶體,沸點都較低,故B錯誤;
C.C和Si同主族,但氧化物的晶體類型不同,分別屬于分子晶體和原子晶體,故C正確;
D.Na和Si不同主族,Na2O屬于離子晶體,SiO2屬于原子晶體,不同族元素的氧化物可形成不同類型的晶體,故D正確;
故答案為:AB;
(2) SiO2晶體中每個Si原子形成4個Si-O鍵,1mol SiO2晶體中含有4molSi-O鍵,則SiO2晶體中Si和Si-O鍵的比例為1:4,因晶體硅中每個Si原子與周圍的4個硅原子形成正四面體,向空間延伸的立體網狀結構,每Si原子與周圍的4個Si原子形成4個Si-Si鍵,每個Si-Si鍵為1個Si原子提供![]() 個Si-Si鍵,所以1mol晶體硅中含有1mol×4×
個Si-Si鍵,所以1mol晶體硅中含有1mol×4×![]() =2molSi-Si鍵,反應熱△H=反應物總鍵能-生成物總鍵能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
=2molSi-Si鍵,反應熱△H=反應物總鍵能-生成物總鍵能,所以Si(s)+O2(g)=SiO2(s)中,△H=176kJ/mol×2mol+498kJ/mol-460kJ/mol×4=-990 kJ/mol;
(3)晶胞中距離最近的原子為位于定點和面心位置的兩個原子,每個定點周圍有3×![]() ×8=12個原子,即配位數為12;觀察晶胞結構可知晶胞中存在兩種空隙,分別是正四面體空隙、正八面體空隙。
×8=12個原子,即配位數為12;觀察晶胞結構可知晶胞中存在兩種空隙,分別是正四面體空隙、正八面體空隙。


科目:高中化學 來源: 題型:
【題目】對已達化學平衡的反應:2X(g)+Y(g)![]() 2Z(g),減小壓強后,對反應產生的影響是
2Z(g),減小壓強后,對反應產生的影響是
A.逆反應速率增大,正反應速率減小,平衡向逆反應方向移動
B.逆反應速率減小,正反應速率增大,平衡向正反應方向移動
C.正反應速率先減小后增大,逆反應速率減小,平衡向逆反應方向移動
D.逆反應速率先減小后增大,正反應速率減小,平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業(yè)上制取冰晶石(Na3AlF6)的化學方程式如下:2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根據題意完成下列填空:
(1) 在上述反應的反應物和生成物中,屬于非極性分子的電子式______,屬于弱酸的電離方程式______。
(2)反應物中有兩種元素在元素周期表中位置相鄰,下列能判斷它們的金屬性或非金屬性強弱的是______(選填編號)。
a.氣態(tài)氫化物的穩(wěn)定性 b.最高價氧化物對應水化物的酸性
c.單質與氫氣反應的難易 d.單質與同濃度酸發(fā)生反應的快慢
(3)反應物中某些元素處于同一周期。它們最高價氧化物對應的水化物之間發(fā)生反應的離子方程式為______。
(4) Na2CO3俗稱純堿,屬于______晶體。工業(yè)上制取純堿的原料是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鈦廣泛用于耐高溫、耐磨損及航空航天等領域。一種氮化鈦的制備反應為:6TiCl4+8NH3=6TiN+24HCl+N2,回答下列問題:
(1)鈦在元素周期表中的位置為_____________,基態(tài)Ti原子價層電子的軌道表達式為________。
(2)氮可與其他元素形成正離子,如NH4Cl中的NH4+,N2O5中的NO2+。組成這兩種正離子的元素中第一電離能由小到大的順序為____________;NH4+的空間構型為___________;NO2+中氮原子的雜化形式為_______,其中σ鍵與π鍵的數目比為_________。
(3)四氯化鈦晶體的熔點為-23℃,沸點為136℃,則TiCl4晶體的類型為___________,該晶體中微粒之間的作用力為___________。
(4)一種TiN金黃色晶體晶胞結構與NaCl相同(如圖),該晶胞中N原子數目為_______;該氮化鈦的密度為5.4g/cm3,則其晶胞參數a=___________pm(用NA表示阿伏加德常數的數值,只列算式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1Q > 0(I)
NaNO3(s)+ClNO(g) K1Q > 0(I)
2NO(g)+Cl2(g)![]() 2ClNO(g)K2 Q > 0 (II)
2ClNO(g)K2 Q > 0 (II)
(1)由(I)(II)得到:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)式子,請寫出平衡常數表達式K=__________________。
2NaNO3(s)+2NO(g)+Cl2(g)式子,請寫出平衡常數表達式K=__________________。
(2)為研究不同條件對反應(II)的影響,在恒溫條件下,向 2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應(II)達到平衡。測得10min內V(ClNO)=7.5×10-3molL-1min-1,則平衡后n(Cl2)=_____________ mol,NO的轉化率а1=____________。30.其它條件保持不變,反應(II)在恒壓條件下進行,平衡時NO的轉化率а2____________а1(填“>”“<”或“=”),平衡常數K2____________(填“增大”“減小”或“不變”)。
(3)若要使K2減小,可采用的措施是_________。
(4)實驗室可用NaOH溶液吸收NO2,反應為2NO2+2NaOH→NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液與0.2mol NO2恰好完全反應得 1L溶液A,溶液B為0.1molL1的CH3COONa溶液,則兩溶液中c(NO3)、c(NO2)和c(CH3COO)由大到小的順序為___________。(已知HNO2的電離常數Ki=7.1×10-4molL1,CH3COOH的電離常數K i=1.7×10-5molL1)。
(5)可使溶液A和溶液B的pH相等的方法是__________。
a.向溶液A中加適量水 b.向溶液A中加適量NaOH
c.向溶液B中加適量水 d..向溶液B中加適量NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分中學化學常見元素原子結構及性質如表所示:
序號 | 元素 | 結構及性質 |
A | A單質是生活中常見金屬,它有兩種氯化物,相對分子質量相差35.5 | |
B | B原子最外層電子數是內層電子總數的1/5 | |
③ | C | C是常見化肥的主要元素,單質常溫下呈氣態(tài) |
④ | D | D單質被譽為“信息革命的催化劑”,是常用的半導體材料 |
① | E | 通常情況下,E沒有正化合價,A、B、C、D、F都能與E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置為____________________________________________。
(2)B與C形成的化合物的化學式為________,它屬于________(填“離子”或“共價”)化合物。
(3)①F與E可以形成原子個數比分別為2∶1、1∶1的兩種化合物X和Y,區(qū)別X與Y的水溶液的實驗方法是____________________
②F與C組成的兩種化合物M和N所含的電子數分別與X、Y相等,則M的水溶液顯________性,N的結構式為________。
(4)C與E都是較活潑的非金屬元素,用化學方程式表明這兩種單質的氧化性強弱____。
(5)有人認為B、D的單質用導線連接后插入氯化鈉溶液中可以形成原電池,你認為是否可以,若可以,試寫出正極的電極方程式(若認為不行可不寫)___________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉭是一種過渡金屬,鉭酸鋰(LiTaO3)可用于制作濾波器。一種制備鉭酸鋰的流程如下:回答下列問題:

(1)LiTaO3中鉭的化合價為___。
(2)同體A呈紅色,其主要成分是___(寫化學式),常見用途有___(填一種即可)。
(3)操作2的名稱是___,用來檢驗溶液B中陰離子的常用試劑是___。
(4)HTaO3是___(填字母)。
a.難溶的強酸 b.可溶的弱酸 c.可溶的強酸 d.難溶的弱酸
(5)燒渣與NaOH溶液轉化成溶液A的過程中,發(fā)生反應的離子方程式為___。
(6)上述廢料中含Ta2O5的質量分數為44.2%,雜質不含Ta元素。現有100kg該廢料,按上述流程最多可制備___kgLiTaO3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組將SO2通入Na2S和Na2SO3的混合溶液中制備硫代硫酸鈉(Na2S2O3)。其裝置如下圖所示(省略夾持裝置),下列說法錯誤的是
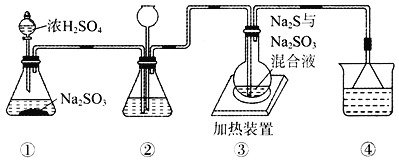
A. 裝置②的作用之一是觀察SO2的生成速率,其中的液體可以是飽和NaHSO3溶液
B. 為提高產品純度,使燒瓶中Na2S和Na2SO3恰好完全反應,則![]()
C. 裝置④的作用是吸收尾氣,同時防止倒吸
D. 裝置①也可用于高錳酸鉀與濃鹽酸反應制備氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q是原子序數依次增大的五種短周期主族元素.其中只有Z是金屬,W的單質是黃色固體,X、Y、W在周期表中的相對位置關系如圖.下列說法正確的是

A. 五種元素中,原子半徑最大的是W
B. Y與Z形成的化合物都可以和鹽酸反應
C. 簡單陰離子的還原性:Y>W
D. Z與Q形成的化合物水溶液一定顯酸性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com