
分析 根據金屬與酸發生反應的條件(在金屬的活動性順序表中排在H前面的金屬能與酸發生反應,產生氫氣,H后面的金屬不能與酸反應)以及金屬與鹽溶液發生反應的條件(在金屬的活動性順序表中排在前面的金屬能把它后面的金屬從其鹽溶液中置換出來)便可判斷金屬的活動性強弱.
解答 解:①把A、B、C、D四種金屬分別浸入稀硫酸中,A、B產生氣泡較劇烈,C、D產生氣泡都很慢,所以A、B的活潑性強于C、D;
②把C、D兩金屬用導線連接后浸入稀硫酸中,氣泡從C金屬片析出,說明C極是氫離子放電,生成氫氣,發生還原反應,所以C是正極,則D的活潑性強于C;
③把A、B兩金屬片用導線連接浸入稀硫酸組成原電池時,電流由A→B,說明A是正極,B是負極,所以B比A活潑;綜上所述金屬的活潑性是:B>A>D>C,故答案為:B>A>D>C.
點評 根據金屬與酸發生反應的條件、以及金屬與鹽溶液發生反應的條件,可判斷金屬的活動性強弱,這一點要求學生要牢牢的掌握.


科目:高中化學 來源: 題型:選擇題
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Fe2+、I-、SO42- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;.
;.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 水不僅是包括人類在內所有生命生存的重要資源,也是化學反應中的重要物質:
水不僅是包括人類在內所有生命生存的重要資源,也是化學反應中的重要物質: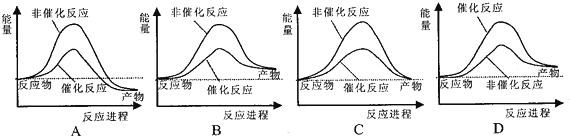
| 物質 | H-H | O=O | H-O |
| 鍵能/(kJ•mol-1) | 436 | 498 | 464 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用CO2合成可降解塑料,實現碳的循環利用 | |
| B. | 提倡使用太陽能、潮汐能、風能等清潔能源,減少化石燃料的使用 | |
| C. | 提高煤炭和石油的產量,以滿足工業生產的快速發展 | |
| D. | 實現資源的“3R”利用,即減少資源消耗(Reduce)、增加資源的重復使用(Reuse)、提高資源的循環利用(Recycle) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
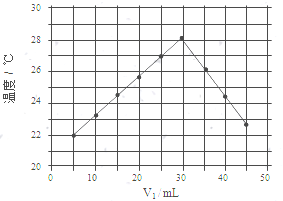
| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
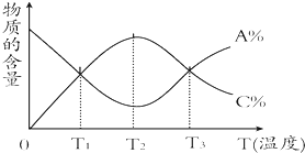
| A. | 該反應在T1、T3溫度時達到化學平衡 | |
| B. | 該反應在T2溫度時未達到化學平衡 | |
| C. | 升高溫度,平衡會向正反應方向移動 | |
| D. | 該反應的正反應是放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液態氧、干冰、硫酸、燒堿、氯化鈉 | B. | 碘酒、冰、鹽酸、燒堿、食鹽 | ||
| C. | 氫氣、二氧化硫、硝酸、純堿、硝酸鉀 | D. | 銅、硫酸鈉、醋酸、石灰水、氯化銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始濃度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡濃度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高溫度,反應的平衡常數減小,則正反應為吸熱反應 | |
| B. | 反應5 min內,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 當容器中為1.2 mol Cl2時,可逆反應達到平衡狀態 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同條件下再達平衡時,c(PCl5)<0.2 mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com