
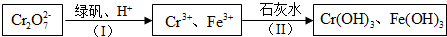
分析 由流程可知,Cr2O72-與亞鐵離子發生氧化還原反應生成鐵離子、鉻離子,然后與石灰水反應轉化為沉淀,從而達到廢水處理的要求.
①結合電子、電荷守恒分析;
②結合c(Cr3+)及Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)計算c3(OH-),再利用Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)計算的c(Fe3+).
解答 解:由流程可知,Cr2O72-與亞鐵離子發生氧化還原反應生成鐵離子、鉻離子,然后與石灰水反應轉化為沉淀,從而達到廢水處理的要求.
①綠礬化學式為FeSO4•7H2O,反應(I)發生氧化還原反應,由電子和電荷守恒可知離子方程式為Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②若處理后的廢水中c(Cr3+)=3.0×10-6 mol•L-1,Ksp[Cr(OH)3]=6.0×10-31,
則c3(OH-)=$\frac{6.0×1{0}^{-31}}{3.0×1{0}^{-6}}$=2.0×10-25,
由Ksp[Fe(OH)3]=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{2.0×1{0}^{-25}}$=2.0×10-13mol/L,
故答案為:2.0×10-13.
點評 本題考查混合物分離提純及溶度積計算,為高頻考點,把握流程中的反應及Ksp的計算為解答的關鍵,側重分析與計算、實驗能力的考查,題目難度不大.


 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸餾操作時,溫度計的水銀球要插入溶液中 | |
| C. | 用蒸發方法使NaCl從溶液中析出時,應將蒸發皿中NaCl溶液全部加熱蒸干 | |
| D. | 用分液漏斗分離水和四氯化碳時,水從上口倒出,四氯化碳從下口放出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HC的電離度最大 | |
| B. | HA溶液酸性最強 | |
| C. | HC溶液酸性最強 | |
| D. | 三種溶液中酸的電離程度:HA<HB<HC |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向溴的煤油溶液里加入苯震蕩 | B. | 向溴水里加入酒精后震蕩 | ||
| C. | 向碘的四氯化碳的溶液里加水震蕩 | D. | 向碘水里加入四氯化碳后震蕩 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 被氧化的元素與被還原的元素質量比為1:1 | |
| B. | NaBH4是氧化劑,H2O是還原劑 | |
| C. | 硼元素被氧化,氫元素被還原 | |
| D. | NaBH4即使氧化劑又是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗編號 | 溶液體積(mL) | 反應后溶液的pH | |
| HA | KOH | ||
| ① | 10 | 10 | |
| ② | 10 | a | 7 |
| A. | 實驗①所得的混合溶液中:c(K+)>c(A-)>c(H+)>c(OH-) | |
| B. | 實驗①所得的混合溶液中:c(OH-)+c(A-)=c(K+)+c(H+) | |
| C. | 實驗②所得的混合溶液中:c(A-)+c(HA)=0.1mol•L-1 | |
| D. | 實驗②所得的混合溶液中:(K+)>c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
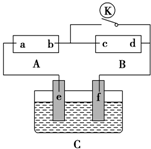 如圖所示,A為直流電源,B為浸透飽和硫酸鈉溶液和紫色石蕊溶液的濾紙,C為電鍍池,接通電路后,發現B上的c點顯藍色,請填空:
如圖所示,A為直流電源,B為浸透飽和硫酸鈉溶液和紫色石蕊溶液的濾紙,C為電鍍池,接通電路后,發現B上的c點顯藍色,請填空:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com