
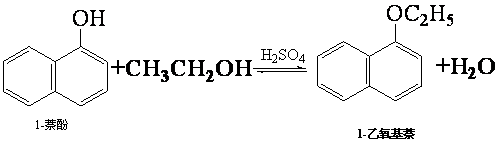
| 物質 | 相對分 子質量 | 狀態 | 熔點(℃) | 沸點(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 無色或黃色菱形結晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 無色液體 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 無色液體 | -114.1℃ | 78.5℃ | 任意比混溶 | |
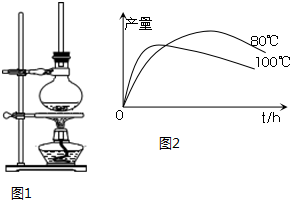
分析 (1)該反應中乙醇的量越多,越促進1-萘酚轉化;
(2)長玻璃管起到冷凝回流的作用,提高乙醇原料的利用率;
(3)該產物沸點高于乙醇,從而降低反應物利用率;
(4)提純產物用10%的NaOH溶液堿洗并分液,把硫酸洗滌去,水洗并分液洗去氫氧化鈉,用無水氯化鈣干燥并過濾,吸收水,控制沸點通過蒸餾的方法得到;
(5)時間延長、溫度升高,1-乙氧基萘的產量下降的原因可能是酚羥基被氧化,乙醇大量揮發或產生副反應等;
(6)根據方程式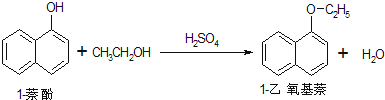 知,1-萘酚與1-乙氧基萘的物質的量相等,則n(C10H8O)=n(C12H12O)=$\frac{72g}{144g/mol}$=0.5mol,則m(C12H12O)=0.5mol×172g/mol=86g,據此計算其產率.
知,1-萘酚與1-乙氧基萘的物質的量相等,則n(C10H8O)=n(C12H12O)=$\frac{72g}{144g/mol}$=0.5mol,則m(C12H12O)=0.5mol×172g/mol=86g,據此計算其產率.
解答 解:(1)該反應中乙醇的量越多,越促進1-萘酚轉化,從而提高1-萘酚的轉化率,故答案為:提高1-萘酚的轉化率;
(2)長玻璃管起到冷凝回流的作用,使揮發出的乙醇冷卻后回流到燒瓶中,從而提高乙醇原料的利用率,故答案為:冷凝回流;
(3)該產物沸點高于乙醇,從而降低反應物利用率,所以不能用制取乙酸乙酯的裝置,
故答案為:不能,產物沸點大大高于反應物乙醇,會降低產率;
(4)提純產物用10%的NaOH溶液堿洗并分液,把硫酸洗滌去,水洗并分液洗去氫氧化鈉,用無水氯化鈣干燥并過濾,吸收水,控制沸點通過蒸餾的方法得到,實驗的操作順序為:③②④①;
故答案為:a;
(5)時間延長、溫度升高,可能是酚羥基被氧化,乙醇大量揮發或產生副反應等,從而導致其產量下降,
故答案為:1-萘酚被氧化;溫度高乙醇大量揮發或溫度高發生副反應;
(6)根據方程式 知,1-萘酚與1-乙氧基萘的物質的量相等,則n(C10H8O)=n(C12H12O)=$\frac{72g}{144g/mol}$=0.5mol,則m(C12H12O)=0.5mol×172g/mol=86g,其產率=$\frac{43g}{86g}$×100%=50%,
知,1-萘酚與1-乙氧基萘的物質的量相等,則n(C10H8O)=n(C12H12O)=$\frac{72g}{144g/mol}$=0.5mol,則m(C12H12O)=0.5mol×172g/mol=86g,其產率=$\frac{43g}{86g}$×100%=50%,
故答案為:50%.
點評 本題考查有機物制備,為高頻考點,明確實驗原理及物質性質是解本題關鍵,對于有機反應大多數學生較陌生,以乙酸乙酯的制取為載體分析解答該實驗,熟練掌握實驗基本操作及物質分離和提純方法,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{m}{32}$ mol-1 | B. | 16m mol-1 | C. | m mol-1 | D. | 32m mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 元素編號 | 元素性質或原子結構 |
| T | 失去一個電子后,形成Ne原子電子層結構 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 其單質之一是空氣中主要成分,最常見的助燃劑 |
| Z | 形成雙原子單質分子,黃綠色氣體 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用1g 98%的濃硫酸加入4g水配制1:4硫酸溶液 | |
| B. | 配制2.0mo1•L-1硫酸溶液時,最后在容量瓶中加水稀釋到標線,塞好蓋子倒轉搖勻后,發現液面低于標線 | |
| C. | 在100mL無水乙醇中,加人2g甲醛配制2%的甲醛灑精溶液 | |
| D. | 在80mL水中,加入18.4mol•L-1濃硫酸20mL,配制3.68mol•L-1稀硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
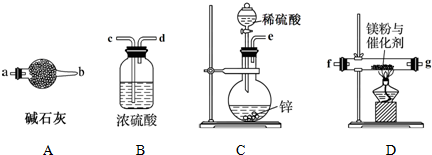
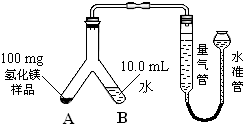
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 乙醇 | 溴乙烷 | 溴 | |
| 狀態 | 無色液體 | 無色液體 | 深紅棕色液體 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸點/℃ | 78.5 | 38.4 | 59 |
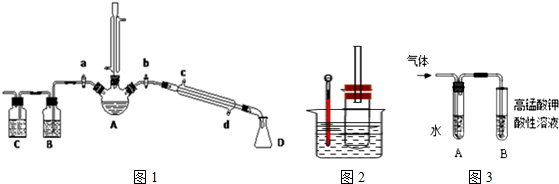
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 甘氨酸(NH2CH2COOH) | 檸檬酸 | 甘氨酸亞鐵 |
| 易溶于水,微溶于乙醇,兩性化合物 | 易溶于水和乙醇,有較強酸性和還原性 | 易溶于水,難溶于乙醇 |
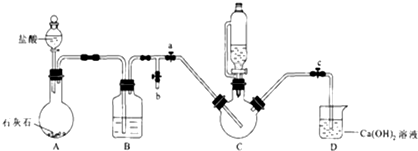
| 實驗 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 體系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 產率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.86 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物質的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化鉀溶液可以檢驗溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液與過量NaOH溶液反應制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com