
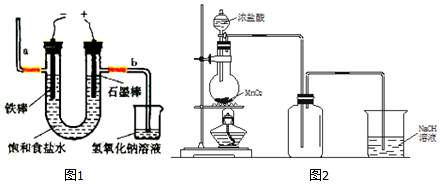
分析 (1)電解法制氯氣,是電解食鹽水生成氫氧化鈉、氫氣、氯氣,在電解池的陽極產生氯氣,陰極產生氫氣,同時有氫氧化鈉產生,據此答題;
(2)二氧化錳與濃鹽酸在加熱條件下反應生成氯氣、氯化錳和水;
(3)①根據裝置圖,盛裝濃鹽酸的儀器名稱為分液漏斗;
②濃鹽酸易揮發,加熱制備的氯氣中含義氯化氫、水蒸氣,結合氯氣在飽和食鹽水中溶解度不大,氯化氫易溶于水,濃硫酸具有吸水性解答;
③氯氣有毒,NaOH溶液的作用收集尾氣;
④用含HCl146g的濃鹽酸與足量的MnO2反應,理論上應生成1mol氯氣,但隨反應進行,濃鹽酸濃度減小變稀到一定程度,不會和二氧化錳反應生成氯氣,所以實際產生氯氣小于1mol;用87gMnO2與足量濃鹽酸反應.通過化學方程式計算可得,生成氯氣為1mol;比較得出答案;
⑤氯氣與水反應,發生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
解答 解:(1)電解法制氯氣,是電解食鹽水生成氫氧化鈉、氫氣、氯氣,在電解池的陽極產生氯氣,陰極產生氫氣,同時有氫氧化鈉產生,
①電解反應的化學方程式為 2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案為:2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+Cl2↑+H2↑;
②電解食鹽水時,鐵做陰極,石墨棒做陽極,氫氧化鈉在陰極即鐵棒附近產生,所以通電后鐵棒附近變紅,圖中b端產生氯氣,檢驗氯氣的方法是用濕潤的淀粉碘化鉀試紙檢驗,若變藍則說明是氯氣,故答案為:鐵棒;試紙變藍;
(2)①根據裝置圖,盛裝濃鹽酸的儀器名稱為分液漏斗,故答案為:分液漏斗;
②濃鹽酸易揮發,加熱制備的氯氣中含有氯化氫、水蒸氣,氯氣在飽和食鹽水中溶解度不大,氯化氫易溶于水,選擇飽和食鹽水除去氯化氫,濃硫酸具有吸水性,可以干燥氯氣;
故答案為:飽和食鹽水、濃硫酸;
③NaOH溶液的作用收集尾氣,發生化學方程式為:Cl2+2NaOH=NaCl+NaClO+H2O,故答案為:收集尾氣;Cl2+2NaOH=NaCl+NaClO+H2O;
④反應化學方程式為MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
理論計算:Ⅰ、含HCl146g的濃鹽酸與足量的MnO2反應,4HCl~Cl2,可得氯氣1mol,但隨鹽酸濃度變稀,溶質HCl不可能全部反應,故實際生成氯氣應小于1mol;
Ⅱ、用87gMnO2與足量濃鹽酸反應,因為濃鹽酸足量,可以使87gMnO2全部反應,故生成氯氣為1mol;所以II比 I多;
故選B;
⑤氯氣可與水反應生成鹽酸和次氯酸,其中鹽酸可使pH變成紅色,次氯酸具有強氧化性,可漂白試紙,最后使試紙褪色.
故答案為:試紙先變紅后褪色.
點評 本題考查實驗室制氯氣的制備方法和凈化,化學方程式計算,主要考查濃度變稀后的鹽酸不會與二氧化錳反應生成氯氣,熟悉制備原理和物質的性質是解題關鍵,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl3具有強氧化性,使血液中的蛋白質被氧化凝固止血 | |
| B. | FeCl3與血液發生化學反應,生成沉淀物質而止血 | |
| C. | FeCl3水解生成Fe(OH)3沉淀而沉積于劃破處止血 | |
| D. | FeCl3是電解質,使血液中的蛋白質很快疑結而止血 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L水中含有1mol硫酸 | B. | 1L溶液中含有1molH+ | ||
| C. | 將98gH2SO4溶于1L水所配制的溶液 | D. | 指1L硫酸溶液中含有1molH2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O和SO2 | B. | HCl和KCl | C. | Na2O2和 H2O2 | D. | NH4F和NaF |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-) | B. | c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com