
【題目】下列指定反應的離子方程式正確的是
A.鋁溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.銅絲插入Fe2(SO4)3溶液中:Cu+Fe3+=Cu2++Fe2+
C.向FeBr2溶液中通入過量Cl2:2Br-+Cl2=Br2+2Cl-
D.用濃鹽酸與MnO2反應制Cl2:MnO2+4H++2Cl-=Mn2++2H2O+Cl2↑
科目:高中化學 來源: 題型:
【題目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序數依次增大的五種短周期元素,且
是原子序數依次增大的五種短周期元素,且![]() 是元素周期表中原子半徑最小元素,
是元素周期表中原子半徑最小元素,![]() 、
、![]() 相鄰,
相鄰,![]() 元素可以與
元素可以與![]() 、
、![]() 、
、![]() 元素分別形成甲、乙、丙三種物質,且甲、乙均為10電子化合物,丙為18電子雙原子化合物。
元素分別形成甲、乙、丙三種物質,且甲、乙均為10電子化合物,丙為18電子雙原子化合物。![]() 元素原子的最外層電子數與核外電子層數相等。已知:甲+丙→丁。下列說法正確的是
元素原子的最外層電子數與核外電子層數相等。已知:甲+丙→丁。下列說法正確的是
A.簡單離子半徑:![]()
B.![]() 與
與![]() 兩種元素共同形成的10電子微粒有3種
兩種元素共同形成的10電子微粒有3種
C.![]() 元素在元素周期表中的位置是第二周期第ⅡA族
元素在元素周期表中的位置是第二周期第ⅡA族
D.丁物質由非金屬元素組成,只含共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向20mLNaOH溶液中逐滴加入![]() 醋酸溶液,滴定曲線如圖所示。下列判斷正確的是
醋酸溶液,滴定曲線如圖所示。下列判斷正確的是
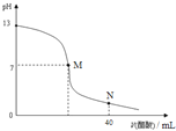
A.在M點,兩者恰好反應完全
B.滴定前,酸中![]() 等于堿中
等于堿中![]()
C.NaOH溶液的物質的量濃度為![]()
![]()
D.在N點,c(CH3COO-)> c(Na+)>c(H+)> c(CH3COOH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是( )
A.2mol水的摩爾質量和1mol水的摩爾質量
B.20%NaOH溶液中NaOH的物質的量濃度和10%NaOH溶液中NaOH的物質的量濃度
C.64g二氧化硫中氧原子數和標準狀況下22.4L一氧化碳中氧原子數g
D.200mL1mol/L氯化鈣溶液中c(Cl-)和200mL1mol/L氯化鉀溶液中c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于各實驗裝置的敘述正確的是( )
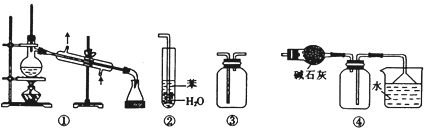
A. 裝置①常用于分離互不相溶的液體混合物
B. 裝置②用于吸收NH3或HCl氣體時,易形成倒吸
C. 裝置③可用于收集H2、CO2、Cl2、NH3、C2H4等氣體
D. 裝置④可用于干燥、收集氯化氫,并吸收多余的氯化氫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置進行下列實驗,將X溶液逐滴加入固體Y中,下列關于試管中的現象描述錯誤的是
選項 | X溶液 | 固體Y | Z溶液 | 現象 |
|
A | 稀硫酸 | Na2O2 | 氫硫酸 | 產生淡黃色沉淀 | |
B | 濃氨水 | 堿石灰 | 氯化鋁溶液 | 產生白色沉淀 | |
C | 濃硝酸 | Cu | 硅酸鈉溶液 | 產生白色沉淀 | |
D | 稀鹽酸 | CaCO3 | 氯化鋇溶液 | 產生白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如下框圖分析,下列說法正確的是
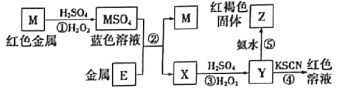
A.E2+的氧化性比M2+的氧化性強
B.在反應③中若不加稀硫酸可能看到紅褐色沉淀
C.反應⑤的離子方程式可表示為E2++3OH-=E(OH)3↓
D.在反應①中只能用濃硫酸,既表現酸性,又表現了氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多晶硅是制作光伏電池的關鍵材料。以下是由粗硅制備多晶硅的簡易過程。
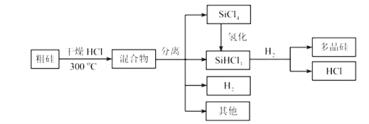
回答下列問題:
(I)硅粉與HCl在300℃時反應生成1mol SiHCl3氣體和![]() ,放出225kJ熱量,該反應的熱化學方程式為________________________。
,放出225kJ熱量,該反應的熱化學方程式為________________________。![]() 的電子式為__________________。
的電子式為__________________。
(II)將![]() 氫化為
氫化為![]() 有三種方法,對應的反應依次為:
有三種方法,對應的反應依次為:
①SiCl4(g)+H2(g)![]() SiHCl3(g)+HCl(g)△H1>0
SiHCl3(g)+HCl(g)△H1>0
②3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2>0
4SiHCl3(g) △H2>0
③3SiCl4(g)+H2(g)+Si(s)+HCl(g)![]() 3SiHCl3△H3
3SiHCl3△H3
反應③的![]() ______(用△H1,△H2表示)。溫度升高,反應③的平衡常數K______(填“增大”、“減小”或“不變”)。
______(用△H1,△H2表示)。溫度升高,反應③的平衡常數K______(填“增大”、“減小”或“不變”)。
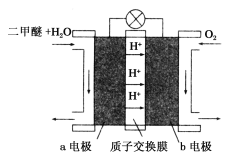
(III)如圖為綠色電源“二甲醚(CH3OCH3)燃料電池”的工作原理示意圖.b電極是________極。請寫出負極的電極反應方程式:__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列有關敘述正確的是( )
A.標準狀況下,22.4L己烷含有的共價鍵總數為19NA
B.1L 0.1 mol·L-1 Na2CO3溶液中陰陽離子數之和為0.3NA
C.16g O2和14C2H4的混合物中所含中子數為8NA
D.密閉容器中l.5mol H2與0.5mol N2充分反應,得到NH3的分子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com