
| 時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
分析 (1)前10min內,△c(X)=(0.6-0.2)mol/L=0.4mol/L、△c(Y)=(0.6-0.4)mol/L=0.2mol/L,相同時間內各物質的濃度變化量之比等于其計量數之比,所以X是NO2、Y是N2O4,前10min內用NO2表示的反應速率=$\frac{△c}{△t}$;
該反應中二氧化氮是反應物、四氧化二氮是生成物,其化學平衡常數K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(2)20min時,二氧化氮濃度增大、四氧化二氮濃度不變,說明改變的條件是改變二氧化氮濃度;
加入二氧化氮相當于增大壓強,平衡向氣體體積減小的方向移動;
(3)N2H4•H2O電離生成N2H5+和OH-;
(4)氨氣分子中的一個H原子被氨基取代生成聯胺,則每個聯胺分子相當于2個氨氣分子,則每mol聯胺能和2molHCl反應;
(5)二者混合后溶液中溶質為等物質的量濃度的N2H4•H2O和N2H5Cl,N2H4•H2O的電離程度大于N2H5Cl的水解程度,導致溶液呈堿性,且其電離和水解程度較小,據此判斷離子濃度大小.
解答 解:(1)前10min內,△c(X)=(0.6-0.2)mol/L=0.4mol/L、△c(Y)=(0.6-0.4)mol/L=0.2mol/L,相同時間內各物質的濃度變化量之比等于其計量數之比,所以X是NO2、Y是N2O4,前10min內用NO2表示的反應速率=$\frac{△c}{△t}$=$\frac{0.4mol/L}{10min}$=0.04mol/(L.min);
該反應中二氧化氮是反應物、四氧化二氮是生成物,其化學平衡常數K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,
故答案為:0.04;$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(2)20min時,二氧化氮濃度增大、四氧化二氮濃度不變,說明改變的條件是改變二氧化氮濃度,加入的二氧化氮物質的量=(1.0-0.6)mol/L×2L=0.8mol;
加入二氧化氮相當于增大壓強,平衡向氣體體積減小的方向移動,導致二氧化氮體積分數減少,
故答案為:向容器中加入0.8mol NO2;B;
(3)N2H4•H2O電離生成N2H5+和OH-,其電離方程式為N2H4•H2O?N2H5++OH- (或N2H4+H2O?N2H5++OH-),故答案為:N2H4•H2O?N2H5++OH- (或N2H4+H2O?N2H5++OH-);
(4)氨氣分子中的一個H原子被氨基取代生成聯胺,則每個聯胺分子相當于2個氨氣分子,則每mol聯胺能和2molHCl反應,
故答案為:2;
(5)二者混合后溶液中溶質為等物質的量濃度的N2H4•H2O和N2H5Cl,N2H4•H2O的電離程度大于N2H5Cl的水解程度,導致溶液呈堿性,且其電離和水解程度較小,則離子濃度大小順序是c(N2H5+)>c(Cl-)>c(OH-)>c(H+),
故答案為:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
點評 本題考查較綜合,涉及離子濃度大小比較、化學平衡計算、化學平衡影響因素、弱電解質的電離等知識點,側重考查學生分析計算及判斷能力,注意題給信息的正確獲取及利用,題目難度中等.


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1.6g臭氧中含有的氧原子數為0.1NA | |
| B. | 18gD2O中含有的質子數為10NA | |
| C. | 50mL12mol•L-1鹽酸與足量MnO2共熱,轉移的電子數為0.3NA | |
| D. | 標準狀況下,11.2L己烷含有的分子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na[Au(CN)2]不溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合價為+1 | |
| C. | 金元素在地殼中能以化合態的形式存在 | |
| D. | 在提煉過程中NaCN作氧化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L氫氣和氧氣的混合氣體,所含分子數為NA | |
| B. | 常溫常壓下,1mol氦氣含有的原子數為2NA | |
| C. | 1molAl3+含有核外電子數為10NA | |
| D. | 17gNH3含有的電子數為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
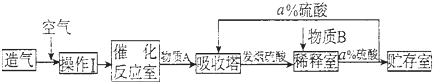
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
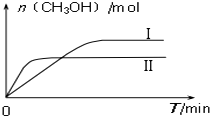 研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義.
研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義.| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| … | ① | ② | ③ | |
| … | ④ | ⑤ |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com