
用雙線橋表示下列反應中得失電子的情況,并按要求回答:
3FeO + 10HNO3= 3Fe(NO3)3 + NO↑ + 5H2O.
(1)氧化劑是 ;氧化產物是 。
(2)在參加反應的硝酸中,起氧化劑(被還原)作用的HNO3與起酸性作用的HNO3的質量比為 。
(3)用雙線橋標明電子轉移的方向和數目 。
(1)HNO3,Fe(NO3)3 (2)1:9
(3)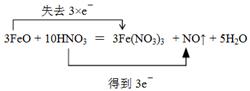
解析試題分析:(1)得到電子,所含元素化合價降低的反應物是氧化劑,氧化劑被還原生成還原產物。反之就是失去電子,所含元素化合價升高的反應物是還原劑,還原劑被氧化生成氧化產物。根據方程式可知,鐵元素的化合價從+2價升高到+3價,所以氧化亞鐵是還原劑,硝酸鐵是氧化產物;硝酸中氮元素的化合價從+5價降低到+2價,得到電子,因此硝酸是氧化劑,NO是還原產物。
(2)如果設氧化亞鐵是1mol,則生成1mol硝酸鐵,即沒有被還原的硝酸是3mol。根據電子的得失守恒可知,被還原的硝酸是1mol÷3,所以在參加反應的硝酸中,起氧化劑(被還原)作用的HNO3與起酸性作用的HNO3的質量比1/3︰3=1︰9。
(3)用雙線橋標明電子轉移的方向和數目起點和終點都是同一種元素,所以根據(1)、(2)分析可知,應該是
考點:考查氧化還原反應的有關判斷、計算及表示等
點評:在進行氧化還原反應的有關判斷計算時,應該僅僅抓住電子得失守恒這一關系式進行列式計算。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2011-2012學年廣東省培正中學高一上學期期中考試化學試卷 題型:填空題
(12分)用雙線橋表示下列反應中得失電子的情況,并指明氧化劑、還原劑、氧化產物、還原產物:
3FeO + 10HNO3 ="== " 3Fe(NO3)3 + NO↑ + 5H2O
( ) ( ) ( ) ( )
其中,氧化性:__________ > ___________ ;還原性:___________ > ___________
查看答案和解析>>
科目:高中化學 來源:2015屆陜西寶雞金臺高一上學期期中質量檢測化學試卷(解析版) 題型:填空題
用雙線橋表示下列反應中得失電子的情況,并按要求回答:
3FeO + 10HNO3 = 3Fe(NO3)3 + NO↑ + 5H2O.
(1)氧化劑是 ;氧化產物是 。
(2)在參加反應的硝酸中,起氧化劑(被還原)作用的HNO3與起酸性作用的HNO3的質量比為 。
(3)用雙線橋標明電子轉移的方向和數目 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com