
【題目】一種以冷熱鍍管廢料鋅灰制ZnSO4·7H2O晶體,進而獲取ZnO,并探索氫電極增壓還原氧化鋅電解法制鋅的方法,工藝流程如圖所示:
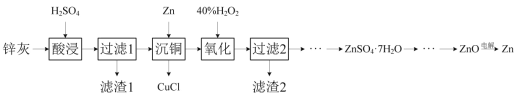
已知:①鋅灰的主要成分為ZnO、ZnCl2,還含有SiO2、CuO、PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列問題:
(1)濾渣1的主要成分為SiO2和___。
(2)酸浸時,硫酸濃度不能過高,原因是___。
(3)寫出“沉銅”時的離子方程式___。
(4)在pH為5.6的條件下氧化后,再加入聚丙烯酰胺絮凝劑并加熱攪拌,其目的是___。
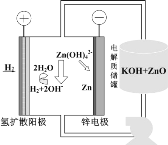
(5)氫電極增壓還原氧化鋅的裝置如圖所示,儲罐內ZnO溶解后形成Zn(OH)![]() 離子,每溶解1molZnO需消耗___molKOH。電解池中的總反應離子方程式為:___。
離子,每溶解1molZnO需消耗___molKOH。電解池中的總反應離子方程式為:___。
(6)該工藝廢水中含有Zn2+,排放前需處理。向廢水中加入CH3COOH和CH3COONa組成的緩沖溶液調節pH,通入H2S發生反應:Zn2++H2SZnS(s)+2H+。處理后的廢水中部分微粒濃度為:
微粒 | H2S | CH3COOH | CH3COO- |
濃度/mol·L-1 | 0.10 | 0.05 | 0.10 |
處理后的廢水的pH=___,c(Zn2+)=___。(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
【答案】PbSO4 產生SO2氣體,污染環境或無法反應(速率慢)等 Zn+2Cu2++2Cl-=2CuCl↓+Zn2+ 促使Fe(OH)3膠體聚沉,有利于過濾分離 2 H2+Zn(OH)![]()
![]() 2H2O+Zn+2OH- 5 1×10-11mol·L-1
2H2O+Zn+2OH- 5 1×10-11mol·L-1
【解析】
鋅灰(主要成分是ZnO,ZnCl2,還含有SiO2,CuO,PbO和FeO等)用硫酸酸浸,其中PbO轉化成PbSO4沉淀,SiO2不溶于酸或水,則過濾得到的濾渣1主要為PbSO4、SiO2;濾液含有ZnSO4、FeSO4、CuSO4和H2SO4,向濾液中加入Zn粉,將Cu2+還原利用生成CuCl沉淀達到沉銅的目的,繼續向溶液中加入雙氧水將Fe2+氧化成Fe3+,再加入ZnO調節溶液pH,將Fe3+轉化成氫氧化鐵沉淀并過濾除去,將濾液蒸發、濃縮并冷卻結晶,過濾得到ZnSO47H2O,濾液加入氫氧化鈉溶液可生成氫氧化鋅,加熱分解生成氧化鋅,最后電解生成Zn,以此解答該題。
(1)由分析可知,濾渣1的主要成分為SiO2和PbSO4;
(2)濃硫酸有強氧化性,酸浸時,如使用硫酸濃度過高,反應速率會很慢,在溶解時會氧化FeO生成Fe3+,同時生成SO2,污染環境,發生反應的化學方程式2FeO+4H2SO4(濃)=Fe2(SO4)3+SO2↑+4H2O;
(3)“沉銅”時加入Zn粉,將Cu2+還原利用生成CuCl沉淀,發生反應的離子方程式為Zn+2Cu2++2Cl-=2CuCl↓+Zn2+;
(4)在pH為5.6的條件下氧化后,生成的Fe3+水解生成氫氧化鐵膠體,繼續加入聚丙烯酰胺絮凝劑并加熱攪拌,可促使Fe(OH)3膠體聚沉,有利于過濾分離;
(5)儲罐內ZnO溶解后形成Zn(OH)![]() 離子,發生的離子反應2OH-+ZnO+H2O=Zn(OH)
離子,發生的離子反應2OH-+ZnO+H2O=Zn(OH)![]() ,則每溶解1molZnO,需消耗2molKOH;電解池陽極上的H2在堿性條件下失電子氧化生成H2O,電極反應為H2-2e-+2OH-=2H2O,陰極上Zn(OH)
,則每溶解1molZnO,需消耗2molKOH;電解池陽極上的H2在堿性條件下失電子氧化生成H2O,電極反應為H2-2e-+2OH-=2H2O,陰極上Zn(OH)![]() 離子得電子還原生成Zn,電極反應式為Zn(OH)
離子得電子還原生成Zn,電極反應式為Zn(OH)![]() +2e-=Zn+4OH-,則電解池中的總反應離子方程式為H2+Zn(OH)42-
+2e-=Zn+4OH-,則電解池中的總反應離子方程式為H2+Zn(OH)42-![]() 2H2O+Zn+2OH-;
2H2O+Zn+2OH-;
(6)已知Ka(CH3COOH)= ![]() ,則c(H+)=1×10-5mol/L,此時溶液pH=5;Ka1(H2S)×Ka2(H2S) =
,則c(H+)=1×10-5mol/L,此時溶液pH=5;Ka1(H2S)×Ka2(H2S) =![]() ×
×![]() =
=![]() =1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,則c(S2-)=1.0×10-12 mol/Lspan>,此時Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),則c(Zn2+)=1×10-11mol·L-1。
=1.0×10-7×1.0×10-14,其中c(H+)=1×10-5mol/L,c(H2S)=0.10mol/L,則c(S2-)=1.0×10-12 mol/Lspan>,此時Ksp(ZnS)=1.0×10-23=c(Zn2+)×c(S2-),則c(Zn2+)=1×10-11mol·L-1。


科目:高中化學 來源: 題型:
【題目】為探討濃度對化學平衡的影響,某同學對可逆反應 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下圖所示步驟進行了一系列實驗。
2Fe2++I2 △H<0”按下圖所示步驟進行了一系列實驗。

說明:0.005 mol·L-1的Fe2(SO4)3溶液顏色接近于無色。
(1)實驗中要待實驗Ⅰ溶液顏色不再改變時,才能進行實驗Ⅱ,目的是 。
(2)實驗Ⅱ中,ⅰ的現象是 ,該實驗證明 。
(3)實驗Ⅱ中,ⅲ的化學平衡向 移動(填“正反應方向”或“逆反應方向”);ⅲ的現象是溶液變淺,該現象 (填“能”或“不能”)說明化學平衡發生移動。如果前一空填“能”,則下一空不填;如果前一空填“不能”,則ⅲ的目的是 。
(4)實驗Ⅱ中,ⅱ的現象是 ,即能證明增大生成物濃度化學平衡發生了逆向移動。
(5)除了上圖中的方法外,若要使該可逆反應的化學平衡逆向移動,還可以采用的方法有 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種重要的化工原料,又是一種可再生能源,具有開發和應用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工業上常以甲醇為原料制取甲醛,請寫出CH3OH(g)與O2(g)反應生成HCHO(g)和H2O(g)的熱化學方程式:________________________________
(2)在一容積為2L的密閉容器內,充入0.2molCO與0.4molH2發生反應CO(g)+2H2(g)![]() CH3OH(g),CO的平衡轉化率與溫度,壓強的關系如圖所示。
CH3OH(g),CO的平衡轉化率與溫度,壓強的關系如圖所示。
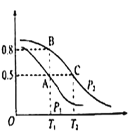
①A、B兩點對應的壓強大小關系是PA________PB(填“>”,“<”,“=”)
②A、B、C三點的平衡常數KA、KB、KC的大小關系是 ___________
③下列敘述能說明上述反應能達到化學平衡狀態的是___(填代號)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的體積分數不再改變
c.混合氣體的密度不再改變
d.CO和CH3OH的物質的量之和保持不變
(3)在P1壓強、T1℃時,該反應的平衡常數K=_________,再加入1.0molCO后重新到達平衡,則CO的轉化率___________(填“增大”、“不變”或“減小”)
(4)T1℃、1L的密閉容器內發生上述反應,測得某時刻各物質的物質的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此時v正 ________ v逆(填>、< 或 =)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某100mL混合液中,HNO3和H2SO4的物質的量濃度分別為0.4mol/L和0.1mol/L。向該混合液中加入1.92g銅粉,加熱使反應發生完全。下列說法正確的是(忽略反應前后溶液體積變化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得氣體在標準狀況下的體積為0.448L D.反應中轉移0.06mol的電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.按要求填空:
(1)濃度均為0.1mol/L的①硫酸 ②醋酸 ③氫氧化鈉 ④氯化銨,四種溶液中由水電離出的H+濃度由大到小的順序是________(填序號)。
(2)現將足量的固體AgCl分別放入下列物質中:①30mL0.02mol/LCaCl2溶液 ②20mL0.01mol/LKCl溶液 ③40mL0.03mol/LHCl溶液 ④10mL蒸餾水 ⑤50mL0.05mol/LAgNO3溶液。AgCl的溶解度由大到小的排列順序是______(填序號)。
(3)Na2CO3溶液中離子濃度由大到小的順序為________。
(4)CuSO4溶液中含有Fe2(SO4)3雜質,除雜試劑為________。
(5)濃的Al2(SO4)3溶液和濃的小蘇打(NaHCO3)溶液混合可用于滅火,請用離子反應方程式表示滅火的原理________。
(6)將25℃下pH=12的Ba(OH)2溶液aL與pH=1的HCl溶液b L混合,若所得混合液為中性,則a:b=________。(溶液體積變化忽略不計)。
II.常溫下,某水溶液M中存在的離子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根據題意回答下列問題:
(1)寫出酸H2A的電離方程式________。
(2)Na2A的水溶液呈________性,原因是(用離子方程式表示):________。
(3)若溶液M由2mol/LH2A溶液與2mol/LNaOH溶液等體積混合而得,若所得溶液M的pH<7,則溶液中離子濃度由大到小順序為________。
(4)已知Ksp(BaA)=1.8×10-10,往20mL1mol·L-1Na2A溶液中加入10mL1mol·L-1BaCl2溶液,混合后溶液中的Ba2+濃度為_______mol·L-1。(忽略A2-的水解)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常見物質之間的一些反應關系,其中部分產物未寫出。常溫下X是固體,B和G是液體,其余均為氣體。根據下圖關系推斷:

(1)寫出化學式:X_______,A________,B_______。
(2)實驗室收集氣體D和F的方法依次是_______法、________法。
(3)寫出C→E的化學方程式:____________。
(4)請寫出A與E反應生成D的化學方程式:_______________
(5)檢驗物質A的方法和現象是________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生興趣小組模擬工業制取無水Na2SO3的過程如下:
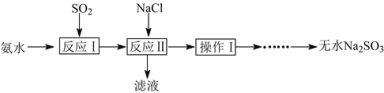
已知:①反應Ⅰ在三頸燒瓶中發生,裝置如圖1所示(固定及加熱類儀器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物質的量分數隨pH的分布如圖2;
③Na2SO3·7H2O和Na2SO3的溶解度曲線如圖3。
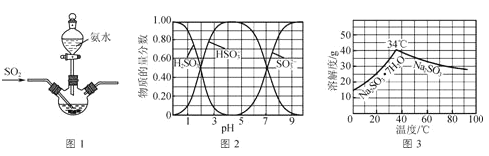
(1)為提高Na2SO3產率,反應Ⅰ應控制pH在____左右。
(2)反應Ⅱ所得濾液的主要成分是____和Na2SO3。
(3)將操作Ⅰ后所得的Na2SO3溶液加熱濃縮、____(填操作),過濾出的固體用無水乙醇洗滌、在真空干燥箱中采用150℃干燥,得無水Na2SO3固體。
(4)可以用KIO3測定產品中無水Na2SO3的純度:稱取0.1260 g樣品于錐形瓶中,用蒸餾水溶解,并加入淀粉做指示劑,滴加酸性KIO3溶液(amol·L-1)至Na2SO3恰好完全氧化成Na2SO4,發生反應3Na2SO3 +KIO3=3Na2SO4+KI,消耗KIO3溶液體積為bmL。通過計算確定樣品中Na2SO3的質量分數____。(寫出計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以淀粉和油脂為原料,制備生活中的某些物質。
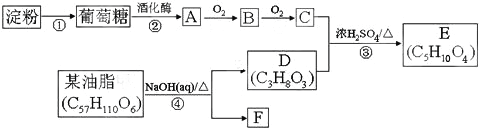
請回答:
(1)D中含有官能團的名稱是____。
(2)反應④的有機反應類型是____。
(3)寫出E可能的結構簡式____。
(4)下列說法不正確的是____。
A.1molD最多可以和3mol金屬Na反應,生成標準狀況下336L氫氣
B.葡萄糖、B以及淀粉這三者均能發生銀鏡反應
C.反應①和反應②的反應類型相同
D.A和D有相同的官能團,兩者屬于同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將10molA和5molB放入容積為10L的密閉容器中,某溫度下發生反應:3A(g)+B(g)![]() 2C(g),在最初2s內,消耗A的平均速率為0.09mol·L-1·s-1,則在2s時,
2C(g),在最初2s內,消耗A的平均速率為0.09mol·L-1·s-1,則在2s時,
(1)容器中有___________molA;
(2)此時C的物質的量濃度為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com