
在恒溫恒壓下,向密閉容器中充入4mol
A和2 mol B,發生如下反應:2A(g)+B(g) 2C(g)
ΔH<0。2min后,反應達到平衡,生成C為1.6mol。則下列分析正確的是 ( )
2C(g)
ΔH<0。2min后,反應達到平衡,生成C為1.6mol。則下列分析正確的是 ( )
A.若反應開始時容器體積為2L,則Vc=0.4mol•L-1•min-1
B.若在恒壓絕熱條件下反應,平衡后nc<<1.6mol
C.若2min后,向容器中再投入等物質的量A、C,B的轉化率不變
D.若該反應在恒溫恒容下進行,放出熱量將增加
B
【解析】
試題分析:由于該反應是體積減小的可逆反應,所以若反應開始時容器體積為2L,則平衡時容器的容積小于2L,所以Vc> =0.4mol•L-1•min-1,A不正確;由于反應是放熱反應,所以如果在恒壓絕熱條件下反應,則溫度升高,不利于平衡向正反應方向進行,則平衡后nc<1.6mol,選項B正確;若2min后,向容器中再投入等物質的量A、C,則相當于是再次通入物質的量之比大于2:1的A和B,所以B的轉化率增大,C不正確;由于該反應是體積減小的可逆反應,所以若該反應在恒溫恒容下進行,則不利于平衡向正反應方向進行,放出熱量將減少,D不正確,答案選B。
=0.4mol•L-1•min-1,A不正確;由于反應是放熱反應,所以如果在恒壓絕熱條件下反應,則溫度升高,不利于平衡向正反應方向進行,則平衡后nc<1.6mol,選項B正確;若2min后,向容器中再投入等物質的量A、C,則相當于是再次通入物質的量之比大于2:1的A和B,所以B的轉化率增大,C不正確;由于該反應是體積減小的可逆反應,所以若該反應在恒溫恒容下進行,則不利于平衡向正反應方向進行,放出熱量將減少,D不正確,答案選B。
考點:考查反應速率的計算、外界條件對反應速率的影響
點評:該題設計新穎,綜合性強,對學生的思維能力要求高,學生不易得分。明確反應的特點,以及反應中的變量是答題的關鍵,有利于培養學生的邏輯推理能力和發散思維能力,有助于提升學生的學科素養。


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012-2013學年四川省成都市高三第一次診斷性考試理綜化學試卷(解析版) 題型:選擇題
在恒溫恒壓下,向密閉容器中充入4mol A和2 mol B,發生如下反應2A(g)+B(g)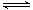 2C(g) △H<0。2 min后,反應達到平衡,生成C為1.6 mol。則下列分析正確的是 ( )
2C(g) △H<0。2 min后,反應達到平衡,生成C為1.6 mol。則下列分析正確的是 ( )
A.若反應開始時容器體積為2 L,則υC=0.4mol/L·min
B.若在恒壓絕熱條件下反應,平衡后nC<1.6mol
C.若2min后,向容器中再投入等物質的量A、C,B的轉化率不變
D.若該反應在恒溫恒容下進行,放出熱量將增加
查看答案和解析>>
科目:高中化學 來源:遼寧模擬 題型:單選題
| A.x=3,y=1 | B.x=2,y=3 | C.x=4,y=1 | D.x=5,y=1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com