
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7個主族、7個副族 | |
| C. | 稀有氣體元素原子的最外層電子數均為8 | |
| D. | 銣、氯、鍺三種元素中,適合作半導體材料的是鍺 |
分析 A.O的原子結構中有2個電子層、最外層電子數為6;
B.元素周期表有18個縱行,16個族;
C.He的最外層電子數為2;
D.位于金屬與非金屬交界處的元素可作半導體材料.
解答 解:A.O的原子結構中有2個電子層、最外層電子數為6,則氧元素位于第2周期VIA族,故A正確;
B.元素周期表有18個縱行,16個族,則元素周期表中有7個主族、7個副族、1個0族,1個第ⅤⅢ族(8、9、10三個縱行),故B正確;
C.He的最外層電子數為2,其它稀有氣體元素原子的最外層電子數均為8,故C錯誤;
D.位于金屬與非金屬交界處的元素可作半導體材料,則銣、氯、鍺三種元素中,適合作半導體材料的是鍺,故D正確;
故選C.
點評 本題考查元素周期表的結構及應用,為高頻考點,把握元素的位置、原子結構、周期表的結構及應用等為解答的關鍵,側重分析與應用能力的考查,注意選項C為易錯點,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 除去96%的乙醇中的少量水制無水乙醇:加入生石灰,振蕩、靜置、蒸餾 | |
| B. | 除去溴苯中混有的少量單質溴:加入足量的NaOH溶液,振蕩、靜置、分液 | |
| C. | CH4和CCl4中的化學鍵均為非極性鍵,CH4、CCl4都是正四面體結構 | |
| D. | 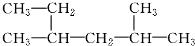 系統命名法為:2,4-二甲基-己烷 系統命名法為:2,4-二甲基-己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的量相等 | B. | 失去電子的物質的量相等 | ||
| C. | 質量比為24:27:26 | D. | 質量比為12:18:28 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
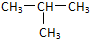 C.12C和13C
C.12C和13C 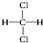 和
和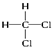
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1mol乙烯與Cl2完全加成,然后與Cl2發生取代反應,共消耗氯氣5mol | |
| C. | 溴水遇到乙醛溶液出現褪色現象,是因為它們發生了氧化還原反應 | |
| D. | 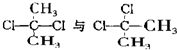 關系為同分異構體 關系為同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 我們常用的元素周期表中元素排序的依據是元素的相對原子質量 | |
| B. | 元素周期表中同一橫行元素原子的電子層數相同 | |
| C. | 元素周期表有16個縱行 | |
| D. | 元素周期表已發展成一個穩定的形式,它不可能再有新的變化了 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
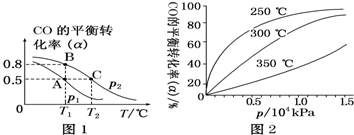 煤的氣化可以減少環境污染,而且生成的CO和H2被稱作合成氣,能合成很多基礎有機化工原料.
煤的氣化可以減少環境污染,而且生成的CO和H2被稱作合成氣,能合成很多基礎有機化工原料.查看答案和解析>>
科目:高中化學 來源:2016-2017學年四川省高一上第一次月考化學卷(解析版) 題型:實驗題
若用12 mol•L-1的濃鹽酸配制0.10 mol•L-1的稀鹽酸480 mL,回答下列問題:
(1)量取濃鹽酸的體積為 mL,如果實驗室有5mL、10mL、50mL量筒,應選用 mL量筒最好。若量取時發現量筒不干凈,用水洗凈后直接量取,所配溶液濃度將 (偏高、偏低、無影響)。
(2)配制時應選用的容量瓶規格為 mL 。
(3)配制時所需儀器除了容量瓶和量筒外,還需要的儀器有: 。
(4) 配制時,將量取的濃鹽酸沿燒杯內壁慢慢注入約100mL水里,并不斷攪拌,目的是 。
(5)若實驗遇下列情況,所配溶液的濃度會有什么影響(填“偏高”,“偏低”或“無影響”)
A.溶解后沒有冷卻便進行定容________________ |
B.最后定容時,俯視觀察液面與容量瓶刻度線________________ |
C.容量瓶內壁附有水珠而未干燥處理_______________ |
D.用量筒量取所需濃鹽酸體積時俯視觀察 。 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com