
 .
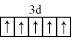
.分析 (1)基態Fe原子有26個電子,所以有26種運動狀態不相同的電子;Fe3+的價電子排布式為3d5;
(2)NaH是離子化合物,陰離子是H-,NaH的電子式為Na+[:H]-;1mol NaOH含有的σ鍵數目為1molO-H鍵,其中O原子三對孤對電子對和一個σ鍵,雜化類型為 sp3;Fe3+可以和SCN-形成配合物,該反應是典型的可逆反應,說明配位原子配位能力弱;
(3)氫氧化鈉和氫化鈉都是離子晶體;而氫負離子的半徑小,所以氫化鈉的晶格能大于氫氧化鈉;
(4)鐵為體心立方密堆積,則晶體中Fe原子的配位數為8;該晶胞中總鐵原子體積=2×$\frac{4}{3}$πr3,晶胞邊長a=$\sqrt{\frac{16}{3}}$r,體心立方晶胞中晶體體積a3=($\sqrt{\frac{16}{3}}$r)3,晶胞空間利用率=$\frac{鐵原子總體積}{晶胞體積}$×100%.
解答 解:(1)基態Fe原子有26個電子,所以有26種運動狀態不相同的電子;Fe3+的價電子排布式為3d5,則Fe3+的價電子排布圖為 ,
,
故答案為:26; ;
;
(2)NaH是離子化合物,陰離子是H-,NaH的電子式為Na+[:H]-;1mol NaOH含有的σ鍵數目為1molO-H鍵,所以σ鍵數目為NA,其中O原子三對孤對電子對和一個σ鍵,雜化類型為 sp3;Fe3+可以和SCN-形成配合物,該反應是典型的可逆反應,說明配位原子配位能力弱,
故答案為:Na+[:H]-;NA;sp3;弱;
(3)氫氧化鈉和氫化鈉都是離子晶體;而氫負離子的半徑小,所以氫化鈉的晶格能大于氫氧化鈉,故答案為:離子;氫負離子的半徑小,所以氫化鈉的晶格能大于氫氧化鈉,所以NaH的熔點顯著高于NaOH;
(4)鐵為體心立方密堆積,則晶體中Fe原子的配位數為8;該晶胞中總鐵原子體積=2×$\frac{4}{3}$πr3,晶胞邊長a=$\sqrt{\frac{16}{3}}$r,體心立方晶胞中晶體體積a3=($\sqrt{\frac{16}{3}}$r)3,
晶胞空間利用率=$\frac{鐵原子總體積}{晶胞體積}$=$\frac{\frac{8}{3}×π×{r}^{3}(Fe)}{[\frac{4}{\sqrt{3}}r(Fe)]^{3}}$,故答案為:8;$\frac{\frac{8}{3}×π×{r}^{3}(Fe)}{[\frac{4}{\sqrt{3}}r(Fe)]^{3}}$.
點評 本題是對物質結構知識的綜合考查,涉及核外電子排布、晶體類型的判斷、晶胞計算等,(4)為易錯點、難點,需要學生熟練掌握金屬晶胞結構,具備一定的數學計算能力,難度中等.


 激活思維優加課堂系列答案
激活思維優加課堂系列答案 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 硫酸銨稀溶液和稀氫氧化鋇溶液反應:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| C. | 把氯氣通入NaOH 溶液中:Cl2+2OH-═Cl-+ClO-+2H2O | |
| D. | 碳酸氫鈣溶液中加入少量的氫氧化鈉:Ca2++HCO3-+OH-═H2O+CaCO3↓ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應屬于復分解反應 | |
| B. | 氧化性:KBrO3<KClO3 | |
| C. | 反應中氧化劑與還原劑的物質的量之比為1:2 | |
| D. | 反應中若有1mol還原劑發生反應,則氧化劑得到10mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 加入金屬鋁后溶液中有大量氣泡產生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 漂白粉溶液中:K+、Na+、I-、CO32- | |
| D. | 在強堿性溶液中能大量存在:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子化合物中可能有離子鍵 | |
| B. | 離子化合物中一定有離子鍵,可能有共價鍵 | |
| C. | 有共價鍵的化合物一定是共價化合物 | |
| D. | 共價化合物中一定有共價鍵,可能有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵具有良好的導電性,氯堿工業中可用鐵作陽極電解食鹽水 | |
| B. | 藥皂中加入少量苯酚,可以起到殺菌消毒的作用 | |
| C. | 銅的金屬活潑性比鐵的差,可在海輪外殼上裝若干銅塊以減緩其腐蝕 | |
| D. | 氯化鋁是一種電解質,可用于電解法制鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
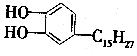 )是生漆的主要成分,顯黃色,能溶于有機溶劑中,漆酚不具有的化學性質是( )
)是生漆的主要成分,顯黃色,能溶于有機溶劑中,漆酚不具有的化學性質是( )| A. | 可以燃燒,當氧氣充足時,產物為CO2和H2O | |
| B. | 與FeCl3溶液發生顯色反應 | |
| C. | 既能與NaOH溶液反應,也能與Na2CO3溶液反應產生氣泡 | |
| D. | 既能與濃溴水發生取代反應,還可能發生加成反應,且1mol漆酚最多消耗5molBr2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com