
 氮元素可形成鹵化物、疊氮化物及絡合物等.
氮元素可形成鹵化物、疊氮化物及絡合物等.分析 (1)NF3的沸點-129℃,符合分子晶體的性質;在銅催化作用下F2和過量NH3反應得到NF3,還生成NH4F;
(2)①原子總數相等、價電子總數也相等的微粒互為等電子體,等電子體的結構相似;
②鈷原子核外電子數為27,根據能量最低原理書寫基態時的價電子排布式;
[Co(N3)(NH3)5]SO4中配體為N3-、NH3;
CN-中C原子價層電子對數=1+$\frac{4+1-3}{2}$=2,雜化軌道數目為2;
(3)根據相似相溶原理,極性分子易溶于極性溶劑;
(4)A.離子半徑越小,晶格能越大;
B.同主族自上而下第一電離能減小,P元素原子3p軌道為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素的;
C.鈉晶胞結構為體心立方密堆積,根據均攤法計算晶胞中分攤鈉原子數目;
D.氮氣性質穩定是由于氮氣分子中含有氮氮三鍵.
解答 解:(1)NF3的沸點-129℃,沸點很低,屬于分子晶體.在銅催化作用下F2和過量NH3反應得到NF3,還生成NH4F,反應方程式為:3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F,
故答案為:分子;3F2+4NH3$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F;
(2)①與N3-互為等電子體的微粒含有3個原子、16個價電子,與其等電子體的分子有N2O或CO2或CS2或BeCl2等,其等電子體的離子有 SCN-等;
N3-與CO2是等電子體,具有相同的價電子數,它們具有相似的化學結構,二氧化碳是直線型分子,所以N3-的空間構型是直線形,
故答案為:CO2;SCN-;直線;
②鈷原子核外電子數為27,其基態原子核外電子排布式為1s22s22p63s23p63d74s2,價電子排布式為3d74s2,
[Co(N3)(NH3)5]SO4中配體為N3-、NH3,鈷的配位數為6,
CN-中C原子價層電子對數=1+$\frac{4+1-3}{2}$=2,雜化軌道數目為2,C原子采取sp雜化;
故答案為:3d74s2;6;sp;
(3)極性分子易溶于極性溶劑中,水為極性溶劑,Pt(NH3)2Cl2的一種分子易溶于水,說明為極性分子;
故答案為:極性;
(4)A.離子電荷相同,鈉離子半徑小于鉀離子半徑,故NaN3的晶格能大于KN3的晶格能,故A錯誤;
B.同主族自上而下第一電離能減小,P元素原子3p軌道為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素的,故第一電離能N>P>S,故B正確;
C.鈉晶胞結構為體心立方密堆積,晶胞中原子數為1+8×$\frac{1}{8}$=2,故C正確;
D.氮氣分子中含有氮氮三鍵,鍵能較大,所以性質穩定,故D錯誤.
故選:BC.
點評 本題是對物質結構與性質的考查,涉及晶體類型與性質、核外電子排布、等電子體、配合物、雜化方式與空間構型、晶胞計算、電離能等,需要學生具備扎實的基礎,注意同周期主族元素第一電離能異常情況.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
 某學生用0.100mol•L-1的KOH標準溶液滴定未知濃度的鹽酸,其操作可分解為如下幾步:
某學生用0.100mol•L-1的KOH標準溶液滴定未知濃度的鹽酸,其操作可分解為如下幾步:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 400 | 500 | 600 |
| SO2轉化率/% | 99.2 | 93.5 | 73.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
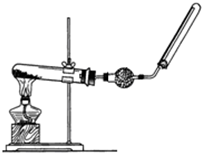 實驗室中若用如圖所示的裝置制取并收集干燥的氨氣.
實驗室中若用如圖所示的裝置制取并收集干燥的氨氣.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ⅠA族元素的金屬性比ⅡA族元素的金屬性強 | |
| B. | 第三周期元素的離子半徑從左到右逐漸減小 | |
| C. | 同周期非金屬氧化物對應的水化物的酸性從左到右依次增強 | |
| D. | ⅣA族元素的氫化物中,穩定性最好的是CH4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com