
| A. | 若增大壓強,平衡向正方向移動,平衡常數變大 | |
| B. | 將容器體積變為20 L,Z的平衡濃度變為0.015mol/L | |
| C. | 達到平衡時X濃度為0.04 mol/L | |
| D. | 若升高溫度,X的體積分數增大,則該反應的△H>0 |
分析 A.平衡常數只隨溫度的變化而變化;
B.由于前后氣體計量數之和不相等,容積增大,壓強減小,化學平衡向逆反應方向移動;
C.根據生成的Z的量求出轉化的X的量,再求出平衡時X的濃度;
D.升高溫度化學平衡向吸熱的方向移動,X的體積分數增大說明平衡逆向進行.
解答 解:A.平衡常數只隨溫度的變化而變化,所以若增大壓強,則平衡常數不變,故A錯誤;
B.容積增大為20L,壓強減小為原來的一半,如果平衡不移動則Z濃度變為原來的 $\frac{1}{2}$,但是壓強減小時,平衡向左移動,Z濃度小于原來的 $\frac{1}{2}$,即Z的平衡濃度小于0.015mol/L,故B錯誤;
C.經60s達到平衡,生成0.3mol Z,則消耗的X為0.6mol,所以達到平衡時X濃度為 $\frac{(1mol-0.6mol)}{10L}$=0.04 mol/L,故C正確;
D.若升高溫度,X的體積分數增大,說明向逆反應方向移動,故逆反應吸熱,則正反應方向為放熱,故△H<0,故D錯誤;
故選C.
點評 本題主要考查化學平衡移動的影響因素,根據反應物濃度、壓強、溫度等因素對平衡移動的影響,可以做出準確的判斷,題目難度中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:選擇題
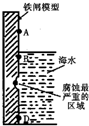
| A. | 該過程發生了析氫腐蝕 | |
| B. | 鐵單質被直接氧化生成Fe3+ | |
| C. | B點附近會生成最多的鐵銹 | |
| D. | 在鐵閘上鑲嵌一些銅片可以減緩海水對鐵閘的腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成物的百分含量一定增加 | B. | 正反應速率大于逆反應速率 | ||
| C. | 反應物的轉化率一定增大 | D. | 反應物濃度一定降低 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等濃度等體積的CH3COOH和CH3COONa溶液混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 常溫下,0.1 mol•L-1HA溶液與0.1 mol•L-1NaOH溶液等體積完全反應時,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常溫下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 常溫下,將0.1 mol•L-1 CH3COOH溶液加水稀釋,當溶液的pH從3.0升到5.0時,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原來的100倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 恒容容器中,對于可逆反應xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量隨時間的變化如圖,下列說法正確的是( )
恒容容器中,對于可逆反應xX(g)+yY(g)?zZ(g)+mM(g),x的百分含量隨時間的變化如圖,下列說法正確的是( )| A. | x+y>z+m | |
| B. | 對反應體系加壓v正>v逆 | |
| C. | 該反應正反應方向為熱反應 | |
| D. | 對反應體系降低溫度達平衡前v逆>v正 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=6的NaHSO3溶液中:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 等物質的量濃度的NH3•H2O溶液和NH4Cl溶液等體積混合后所得的溶液中,2c(OH-)+c(NH3•H2O)=2c(H+)+c(NH4+) | |
| C. | 等體積、等物質的量濃度的 Na2CO3溶液與 NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com