
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
分析 Cu元素化合價由0價升高為+2價,每個Cu原子失2個電子,得失電子守恒,由Na守恒可知n(NaOH)=n(NO)+n(NO2)+2n(N2O4),據此混合氣體中NO的物質的量.
解答 解:Cu元素化合價由0價升高為+2價,每個Cu原子失2個電子;另一個是HNO3→NaNO2,N元素由+5價降低為+3價,每個N原子得2個電子,51.2gCu共失電子為$\frac{51.2g}{64g/mol}$×2=1.6mol,共轉移電子的物質的量為:1.6mol×2=3.2mol,所以得失電子守恒3n(NO)+n(NO2)+2n(N2O4)=3.2mol,由Na守恒可知n(NaOH)=n(NO)+n(NO2)+2n(N2O4)=0.5L×2mol/L=1mol,而混合物共0.9mol,所以n(NO)+n(NO2)+n(N2O4)=0.9mol,解之得n(NO)=0.3mol,故選:A.
點評 本題考查氧化還原反應的有關計算,難度中等,用得失電子和組成之比守恒是解題的關鍵.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
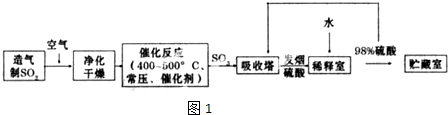
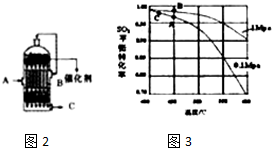
 ,反應Ⅲ的化學方程式為
,反應Ⅲ的化學方程式為 .
.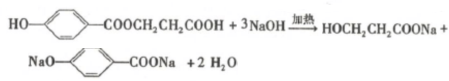 .
.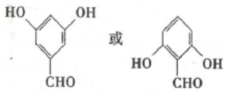 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
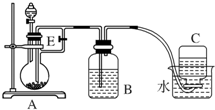 如圖所示裝置可用來制取Fe(OH)2和觀察Fe(OH)2在空氣中被氧化時的顏色變化.實驗提供的試劑:鐵屑、6mol/L硫酸溶液、NaOH溶液.下列說法錯誤的是( )
如圖所示裝置可用來制取Fe(OH)2和觀察Fe(OH)2在空氣中被氧化時的顏色變化.實驗提供的試劑:鐵屑、6mol/L硫酸溶液、NaOH溶液.下列說法錯誤的是( )| A. | B中盛有一定量的NaOH溶液,A中應預先加入的試劑是鐵屑 | |
| B. | 實驗開始時應先將活塞E關閉 | |
| C. | 生成Fe(OH)2的操作為:關閉E,使A中溶液壓入B瓶中 | |
| D. | 取下裝置B中的橡皮塞,使空氣進入,有關反應的化學方程式為:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
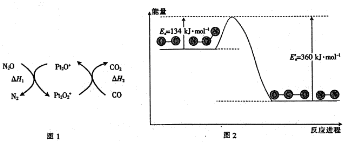
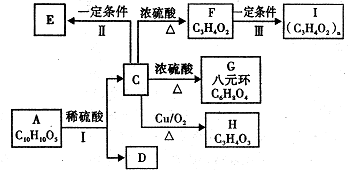
| A. | 由圖1可知:△H1=△H+△H2 | |
| B. | 由圖2可知△H=-226 kJ/mol | |
| C. | 為了實現轉化需不斷向反應器中補充Pt2O+和Pt2O2+ | |
| D. | 由圖2可知該反應正反應的活化能大于逆反應的活化能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
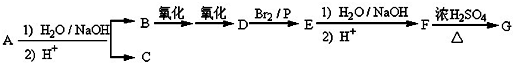

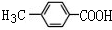 .
.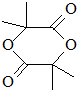 .
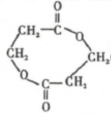
.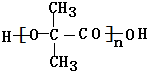 +(n-1)H2O,該反應屬于縮聚反應(填反應類型).
+(n-1)H2O,該反應屬于縮聚反應(填反應類型).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com