
【題目】常溫下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐漸降低,此時溶液中含碳微粒的物質的量分數變化如圖所示(CO2因逸出未兩出,忽略因氣體逸出引起的溶液體積變化),下列說法不正確的是( )
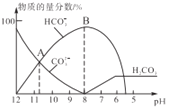
A.Kw(CO32-)的數量級為10-4
B.當溶液是中性時,溶液的總體積大于20 mL
C.在0.1 mol/L Na2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D.在B點所示的溶液中離子濃度最大的是HCO3-
【答案】D
【解析】
A. 根據圖象可知當c(HCO3-)=c(CO32-)時,H2CO3的第二步電離平衡常數Ka2=c(H+)>10-11,碳酸根離子水解方程式:CO32-+H2O![]() HCO3-+OH-,當c(HCO3-)=c(CO32-)時,Kw(CO32-)水解平衡常數Kw(CO32-)
HCO3-+OH-,當c(HCO3-)=c(CO32-)時,Kw(CO32-)水解平衡常數Kw(CO32-)![]() ,Kw(CO32-)的數量級為10-4,A正確;
,Kw(CO32-)的數量級為10-4,A正確;
B. 當Na2CO3的物質的量與HCl的物質的量相等時,二者恰好反應產生NaCl和NaHCO3,加入的HCl體積是10 mL,此時溶液總體積為20 mL,NaHCO3是強堿弱酸酸式鹽,HCO3-水解程度大于其電離程度,使溶液呈堿性,若要使pH=7,則HCl的物質的量要比Na2CO3的稍微多些,即加入的鹽酸體積應大于10 mL,此時溶液的總體積大于20 mL,B正確;
C. 任何電解質溶液中都存在電荷守恒,①c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);溶液中還存在物料守恒:②c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),將②帶入①式,整理可得:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-),所以c(OH-)>c(H2CO3)+c(HCO3-)+c(H+),C正確;
D. B點溶液中溶質為NaHCO3,鈉離子不水解,HCO3-會發生水解反應、電離作用而消耗,水電離產生的H+、OH-的離子濃度很小,所以溶液中濃度最大的陽離子是Na+,D錯誤;
故合理選項是D。


科目:高中化學 來源: 題型:
【題目】一定溫度下,在2.5L的恒容密閉容器中發生如下反應:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
實驗 | 溫度/K | 起始物質的量/mol | 平衡物質的量/mol | 平衡常數 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列說法不正確的是( )
A. 該反應正反應為吸熱反應
B. 607K時,把物質的量均為0.1mol四種反應物加入該反應器中,反應將向正反應方向進行
C. 實驗Ⅱ達到平衡時容器中COS的物質的量為0.02mol
D. 實驗Ⅲ中,無論是開始還是至化學平衡狀態,混合氣體的密度始終不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】部分弱酸的電離平衡常數如表:

(1)上表的6種酸進行比較,酸性最弱的是:_____;HCOO-、S2-、HSO3-三種離子中,最難結合H+的是__________。
(2)在濃度均為0.1mol/L的HCOOH和H2C2O4混合溶液中,逐漸滴入0.1mol/L的NaOH溶液,被OH-先后消耗的酸及酸式酸根依次是:_________。
(3)已知HNO2具有強氧化性,弱還原性。將HNO2溶液滴加到H2S溶液中,同時有沉淀和無色氣體生成,該氣體遇空氣立即變為紅棕色,試寫出兩酸之間的化學反應方程式:___。
(4)下列離子方程式書寫正確的是________。
A.HNO2+HS-=NO2-+H2S↑
B.2HCOOH+SO32-=2HCOO-+H2O+SO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32-
D.H2SO3+SO32-=2HSO3-
E.H2C2O4+NO2-=HC2O4-+HNO2
(5)將少量的SO2通入Na2C2O4溶液,寫出離子方程式___。
(6)已知HX為一元弱酸。HX的電離常數為5.5×10﹣8。某混合溶液中含有4molNaX、2molNa2CO3和1molNaHCO3。往溶液中通入3molCO2氣體,充分反應后,氣體全部被吸收,計算某些物質的量:Na2CO3______、NaHCO3______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于實驗的說法正確的是![]()
實驗目的 | 實驗方案 | |
A | 除去苯中溶有的苯酚 | 取苯與苯酚的混合液,加入濃溴水,過濾 |
B | 證明 | 將 |
C | 分離 | 將混合液倒入過濾器中過濾 |
D | 酸性: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應的焓變通常用實驗進行測定,也可理論推算,回答下列問題。
(1)實驗測得,1 g CH3OH(l)在氧氣中充分燃燒生成二氧化碳和液態水釋放出22.7kJ的熱量,試寫出甲醇燃燒的熱化學方程式_______________________________________。
(2)已知某工業生產中甲烷與水蒸汽存在如下反應:
i.CH4(g)+H2O(g)=CO(g)+3H2(g) △H1
ii.CO(g)+H2O(g)=CO2(g)+H2(g) △H2
iii.CH4(g)=C(s)+2H2(g) △H3
……
Iii為積炭反應,利用△H1和△H2計算△H3時,還需要利用_____________反應的△H。(寫化學方程式)
(3)氯化氫轉化為氯氣的催化過程如下:
CuCl2(s)=CuCl(s)+![]() Cl2(g) △H1=+83 kJ·mol-1
Cl2(g) △H1=+83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) △H2=-20 kJ·mol-1
Cl2(g) △H2=-20 kJ·mol-1
CuO(s)+2HCl(g)= CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
則4HCl(g)+ O2(g)= 2Cl2(g)+2H2O(g)的△H=___________kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由γ-羥基丁酸生成γ-丁內酯的反應如下:
![]()
γ-羥基丁酸水溶液的初始濃度為1.50 mol/L,在不同溫度下測得γ-羥基丁酸的濃度隨時間變化的數據如表所示。回答下列問題:
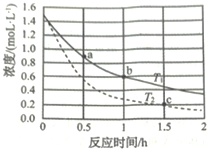
(1)溫度T1________T2(大于、小于、相等、不能確定)。
(2)b點時用γ-丁內酯表示的反應速率ν(丁內酯)=_____________。
(3)c點時γ-羥基丁酸的轉化率a%=__________。(保留小數點后1位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的化學方程式中,書寫正確的是
A.CH4和Cl2混合后光照:CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2通入Br2的CCl4溶液中:CH2=CH2+Br2→CH3CHBr2
C.CH3CH2OH在Cu作催化劑條件下與O2反應: CH3CH2OH+O2![]() CH3COOH+H2O
CH3COOH+H2O
D.CH3COOH與CH3CH2OH 發生酯化反應:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃時,H2R及其鈉鹽的溶液中,H2R、HR-、R2-分別在三者中所占的物質的量分數(α)隨溶液pH變化關系如下圖所示,下列敘述錯誤的是
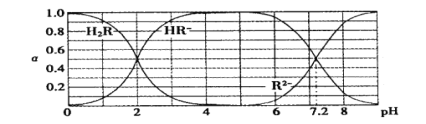
A.H2R是二元弱酸,其Ka1=1×10-2
B.當溶液恰好呈中性時,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解傾向大于電離傾向
D.含Na2R與NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2O2分解速率受多種因素影響。實驗測得 70 ℃時不同條件下H2O2濃度隨時間的變化如圖所示。下列說法正確的是
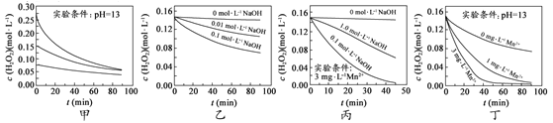
A.圖甲表明,其他條件相同時,H2O2濃度越小,其分解速率越快
B.圖乙表明,其他條件相同時,溶液pH越小,H2O2分解速率越快
C.圖丙表明,少量Mn 2+存在時,溶液堿性越強,H2O2分解速率越快
D.圖丙和圖丁表明,堿性溶液中,Mn2+對H2O2分解速率的影響大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com