
| A. | 原溶液中投入鐵粉的物質的量是0.2mol | |
| B. | 原溶液中HNO3的濃度是1.5mol | |
| C. | 反應后的溶液中還可溶解7.2g銅 | |
| D. | 反應后的溶液中c(Fe2+):c(Fe3+)=1:1 |
分析 溶液質量增重為參加反應Fe的質量與生成NO的質量之差,再根據電子轉移守恒列方程計算溶液中n(Fe2+)、n(Fe3+),進而計算該題.
解答 解:生成NO的物質的量為$\frac{5.6L}{22.4L/mol}$=0.25mol,
設Fe2+、Fe3+的物質的量分別為xmol、ymol,
由溶液質量增重9.3g,則:(x+y)mol×56g/mol-0.25mol×30g/mol=9.3g,
由電子轉移守恒,則:2xmol+3ymol=0.25mol×3,
聯立方程,解得x=0.15、y=0.15,
反應后c(Fe2+):c(Fe3+)為=0.15:0.15=1:1,
A.原溶液中投入鐵粉物質的量是0.15mol+0.15mol=0.3mol,故A錯誤;
B.n(HNO3)=2n(Fe2+)+3n(Fe3+)+n(NO)=2×0.15mol+3×0.15mol+0.25mol=1mol,c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,故B錯誤;
C.由反應2Fe3++Cu=2Fe2++Cu2+可知,還可溶解0.075molCu,質量為0.075mol×64g/mol=4.8g,故C錯誤;
D.由以上計算可知反應后的溶液中c(Fe2+):c(Fe3+)=1:1,故D正確;
故選D.
點評 本題考查氧化還原反應的計算、氧化還原反應基本概念,為高頻考點,側重于學生的分析能力和計算能力的考查,利用電子轉移守恒計算,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | “地溝油”經過加工處理后,可以用來制肥皂 | |
| B. | “亞硝酸鹽”可作某些食品的添加劑 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | D C A B | B. | A D C B | C. | B A D C | D. | A D B C |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| W | 氮 | Y | |
| X | 硫 | Z |
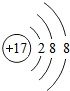 ;寫出工業生產X單質粗產品的化學方程式:2C+SiO2$\frac{\underline{\;高溫\;}}{\;}$Si+2CO.
;寫出工業生產X單質粗產品的化學方程式:2C+SiO2$\frac{\underline{\;高溫\;}}{\;}$Si+2CO.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以區別 | |
| B. | 蛋白質可以通過燒焦時的特殊氣味進行鑒別 | |
| C. | 乙烯和聚乙烯分子中均含有碳碳雙鍵 | |
| D. | 糖類、油脂和蛋白質均可發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com